
【题目】下列说法正确的是( )
A. 某放热反应能自发进行,因此该反应是熵增反应
B. 用惰性电极电解含有H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子
C. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=- (Ea-Eb) kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=- (Ea-Eb) kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后溶液质量分数小于2x%,则A可能为乙醇
【答案】D
【解析】A、某放热反应能自发进行,放热反应△H<0,要满足△G=△H - T△S<0 ,△S可以大于0、等于0、小于0,因此该反应不一定是熵增反应,故A错误;B、可以得到三种氧分子(1)分子质量为36,就是两个O-18结合在一起的;(2)分子质量为32,就是两个O-16结合在一起的(3)分子质量34,是一个O-18和一个O-16结合形成的,故B错误;C、△H=正反应的活化能-逆反应的活化能=(Ea-Eb) kJ/mol,故C错误;D、对于浓度越大,物质的质量分数越大的物质,等体积混合后,质量分数就大于混合前的质量分数,对于浓度越小质量分数越大的物质,等体积混合后,质量分数就小于混合前的质量分数,前者如浓硫酸,后者如乙醇、氨水等,故D正确。故选D。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2 3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
 .
.
(1)①仪器c的名称是_________________。
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞_________(选填“a”、“b”或“a 和 b”)。
(2)装置A中Cu(NO3)2 3H2O和SOC12发生反应的化学方程式是________________。
(3)装置B的作用是________________。
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2 3H2O的实验方案如下:
![]()
己知几种离子生成氢氧化物沉淀的pH如下表
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.2 | 6.7 |
①步骤I中所用稀HNO3稍过量的目的是_____________。
②请补充完整由溶液I制备Cu(NO3)2 3H2O晶体的实验方案:
向溶液I中加入__________,冰水洗涤得到Cu(NO3)2 3H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-393.2 kJ/mol。维持723K,向一恒容的密闭容器A中通入2 mol SO2和1 mol O2,达到平衡时,放出热量Q1;维持723K,向另一个容积与A相同的恒容密闭容器B中通入1 mol SO2和0.5 mol O2,平衡时放出热量为Q2。下列判断不正确的是
2SO3(g) ΔH=-393.2 kJ/mol。维持723K,向一恒容的密闭容器A中通入2 mol SO2和1 mol O2,达到平衡时,放出热量Q1;维持723K,向另一个容积与A相同的恒容密闭容器B中通入1 mol SO2和0.5 mol O2,平衡时放出热量为Q2。下列判断不正确的是
A. 达到平衡时,以SO2表示的正反应速率A中比B中大
B. 达到平衡时,O2的转化率A中比B中大
C. 达到平衡时,混合气体的密度A中比B中小
D. 达到平衡时,放出的热量Q2< 1/2Q1 < 196.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 共价化合物中可能含有离子键
B. 区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
C. 离子化合物中只含有离子键
D. 离子化合物在熔融状态下能电离出自由移动的离子,而共价化合物不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
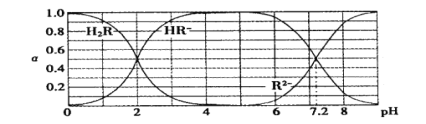
A.H2R是二元弱酸,其Ka1=1×10-2
B.当溶液恰好呈中性时,c( Na + )=2c ( R2- ) + c( HR- )
C.NaHR在溶液中水解倾向大于电离倾向
D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述正确的是( )
A.元素周期表中有18列,即18个族
B.目前使用的元素周期表中,最长的周期含有32种元素
C.短周期元素是指1~20号元素
D.原子的种类和元素的种类一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015海南卷】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com