
| A、稀释浓硫酸时,应将蒸馏水沿烧杯内壁缓慢地注入浓硫酸中并不断搅拌 |
| B、配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| C、配制1mol?L-1 300mL NaCl溶液可以选择一个50mL的容量瓶和一个250mL的容量瓶 |
D、可以用如图装置进行氯气的尾气处理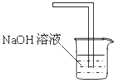 |
 可用于吸收含有氯气的尾气,故D正确;
可用于吸收含有氯气的尾气,故D正确;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| B、标准状况下,22.4L NH3中含有共价键的数目为NA |
| C、1mol Cl2与足量Fe反应转移电子数一定为3NA |
| D、标准状况下,11.2L SO3所含的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入适量NaCl溶液 |
| B、加入适量NaOH溶液 |
| C、加入数滴CuCl2溶液 |
| D、加入适量NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应正反应是吸热反应 |
| B、升高温度,正反应速率加快,逆反应速率减慢 |
| C、该反应达到平衡的标志是压强不再发生改变 |
| D、830℃时平衡常数为1.0,即在此温度下CO2的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3mol?L-1 |
| B、0.03mol?L-1 |
| C、0.05mol?L-1 |
| D、0.06mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
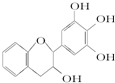 茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A、分子中所有的原子共面 |
| B、1 mol EGC与4 mol NaOH恰好完全反应 |
| C、易发生氧化反应和取代反应,能发生加成反应 |
| D、遇FeCl3溶液不发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸保存在棕色玻璃试剂瓶中 |
| B、少量的金属锂保存在煤油中 |
| C、氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 |
| D、少量液溴通常保存在棕色玻璃试剂瓶中,并在液溴上加少量水液封 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.56mol/L |
| B、4.36mol/L |
| C、5.00mol/L |
| D、5.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
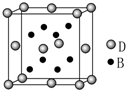 已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com