


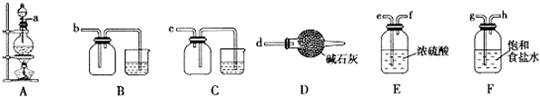
分析 本题是实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程,涉及SO2的氧化性和还原性的检验,装置的连接及气密性的检验,还探究了如何证明铁红Fe2O3样品中含有FeO的实验设计,可借鉴Fe3+的检验及Fe2+与Fe3+的转化来实验,
(1)固体的焙烧在坩埚内进行;
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性;
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O;
②生成的Cl2含有HCl、H2O,所以a连接g、h,通过饱和食盐水除去HCl、继续连接e、f,通过浓硫酸,除去H2O,再连接b,即可收集纯净、干燥的氯气;
③利用加热气体膨胀的原理进行装置气密性的检验,所以检验方法为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气;
④因为该检验方法是先通入氯气,再滴加KSCN溶液,在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的,所以该实验设计不合理;
(4)根据Fe元素守恒可得:2CuFeS2~Fe2O3,以此计算该黄铜矿中含CuFeS2的质量分数.
解答 解:(1)固体的焙烧在坩埚内进行,
故答案为:坩埚;
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性,
故答案为:漂白;氧化;
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O,离子方程式为:MnO2+4H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑2H2O,
故答案为:MnO2+4H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑2H2O;
②生成的Cl2含有HCl、H2O,所以a连接g、h,通过饱和食盐水除去HCl、继续连接e、f,通过浓硫酸,除去H2O,再连接b,即可收集纯净、干燥的氯气,所以连接顺序为g→h→e→f→b,
故答案为:g→h→e→f→b;
③利用加热气体膨胀的原理进行装置气密性的检验,所以检验方法为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气,
故答案为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气;
④因为该检验方法是先通入氯气,再滴加KSCN溶液,在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的,所以该实验设计不合理,
故答案为:否;在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的;
(4)根据Fe元素守恒可得:2CuFeS2~Fe2O3,所以该黄铜矿中含CuFeS2的质量分数=$\frac{8g×368}{20g×160}$×100%=92%,
故答案为:92%.
点评 本题考查了物质制备过程分析判断,物质性质的理解应用,化学方程式和离子方程式书写方法,掌握基础是关键,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制取氢气 | |
| B. | 大量设立水电站,用电力分解水制取氢气. | |
| C. | 设法将太阳能聚焦,产生高温,使水分解产生氢气. | |
| D. | 寻找更多的化石燃料,利用其燃烧放热,使水分解产生氢气. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷含有分子数为0.5NA | |
| B. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| C. | 1mol甘氨酸(α-氨基乙酸)分子中存在9NA对共用电子 | |
| D. | 1L0.1mol/L的苯酚分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2和CO2都属于酸性氧化物 | |
| B. | 甲烷和和一氯甲烷都属于烷烃 | |
| C. | 碱性氧化物都是金属氧化物 | |
| D. | 在水溶液中能电离出H+的化合物都属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NaOH 溶液并加热 | 加热前D的试管中闻 到特殊香味,加热后只有C仍有分层现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水中一定能全部溶解 | |
| B. | Cu能导电,因此Cu是电解质 | |
| C. | 弱电解质溶液的导电性可能比强电解质溶液的导电性强 | |
| D. | NaCl是电解质,故NaCl固体能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,硅甲烷的密度小于甲烷 | |
| B. | 硅甲烷燃烧生成二氧化硅和水 | |
| C. | 硅烷的分子通式可表示为SinH2n+2 | |
| D. | 硅甲烷与硅乙烷的相对分子质量相差30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 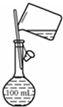 配制150mL 0.1 mol/L盐酸 | B. |  验证氨水呈碱性 | ||
| C. | 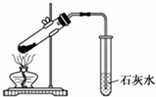 探究NaHCO3的热稳定性 | D. | 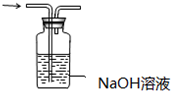 除去二氧化碳中的氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com