
【题目】铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学,为测定某铝镁合金(不含其他元素)中镁的质量分数,设计下列不同实验方案进行探究。填写下列空白。

探究一
实验方案:铝镁合金加入某溶液,测定剩余固体质量(实验装置如图所示)。用单线桥表示出所发生反应的电子转移情况
(1)_________________________________________________。
(2)实验前,先将镁铝合金在稀酸中浸泡片刻,其目的是_____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是___(填序号);记录C的液面位置时,除视线平视外,还应________________。
(4)称取铝镁合金粉末样品m g于B中,向A中加入上述某溶液,反应后测得生成气体体积标况下为VmL,则镁的质量分数为________________。
探究二
实验方案:铝镁合金![]() 测定生成气体的体积(实验装置如图所示),问题讨论:
测定生成气体的体积(实验装置如图所示),问题讨论:

(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是________(填“需要”或“不需要”)。为什么?_________________________
(2)现取镁铝合金粉末0.78g,完全反应后生成的气体的体积在标况下为896mL,则合金粉末中铝的物质的量为________,镁的质量分数为___________。
【答案】 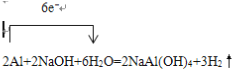 除去铝镁合金表面的氧化膜 ⑤①④③② 使D和C的液面相平,溶液冷却至室温
除去铝镁合金表面的氧化膜 ⑤①④③② 使D和C的液面相平,溶液冷却至室温 ![]() 不需要 酸雾易溶于水 0.02mol 30.8%
不需要 酸雾易溶于水 0.02mol 30.8%
【解析】探究一(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,单线桥表示出所发生反应的电子转移情况,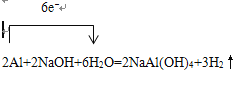 ;(2)实验前,先将镁铝合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜;(3)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,操作的顺序是⑤①④③②(填序号);记录C的液面位置时,除视线平视外,还应使D和C的液面相平,溶液冷却至室温。(4)由方程式
;(2)实验前,先将镁铝合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜;(3)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,操作的顺序是⑤①④③②(填序号);记录C的液面位置时,除视线平视外,还应使D和C的液面相平,溶液冷却至室温。(4)由方程式
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 67.2L
x VL
x=54g×VL/67.2L=54V/67.2g,镁的质量分数=![]() ×100%=
×100%=![]() ;
;
探究二:(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;(2)由题意:令Al和Mg的物质的量分别是x、y,则有27x+24y=0.78,又由电子守恒3x+2y=2×0.896L/22.4L·mol-1,解得x=0.02mol,y=0.01mol,镁的质量分数为![]() ×100%=30.8%。
×100%=30.8%。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量等)改变,不会引起产物改变的是( )
A. Na2O2和CO2 B. NaOH和CO2 C. Na和O2 D. Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制和治理CO2是解决温室效应及能源问题的有效途径。
(1)研究表明,在Cu/ZnO催化剂存在下,CO2和H2 反应生成液态甲醇和液态水,该反应的热化学方程式为________________。
己知:H2(g)和CH3OH(l)的标准燃烧热分別为283.0 kJ mol-1和726. 5kJ mol-1
(2)已知:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H,在两个固定容积均为2 L的密闭容器中以不同的氢碳比[
C2H4(g)+4H2O(g) △H,在两个固定容积均为2 L的密闭容器中以不同的氢碳比[![]() ]充入H2和CO2,CO2的平衡转化率a(CO2)与温度的关系如图所示。
]充入H2和CO2,CO2的平衡转化率a(CO2)与温度的关系如图所示。
①X_____________(填“大于”“小于”或“等于”) 2.0;
②若起始加入的CO2、H2的物质的量分別为1mol和2mol,计算P点时的K=____________,
③比较P点和Q点的化学平衡常数:KP______KQ(填“大于”、“小于”或“等于”),理由是_____________。

(3)以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将CO2转化为低碳烯烃,工作原理如图所示。
①H+的移动方向是_____________(填从左至右或从右至左);
②产生乙烯的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水,稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4反应的化学方程式为:CuCl(s)+3HCl(aq)![]() H3CuCl4(aq)。
H3CuCl4(aq)。
Ⅰ.实验室用图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl+2H2O=2CuCl43+SO42+4H+
CuCl43(aq)![]() CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)

⑴装置A中分液漏斗中的试剂应该是____________。
A.稀硫酸 B.98%的硫酸 C.65%的硫酸
⑵装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。
![]()
操作ⅱ的主要目的是_______;操作ⅳ中宜选用的试剂是____________。
⑶实验室保存新制CuCl晶体的方法是___________________________。
⑷欲提纯某混有铜粉的CuCl晶体,请简述实验方案_______________。
Ⅱ.某同学利用如图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。

已知:①CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
②保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
(5)为了确保实验正确性,D、E、F、G测定气体顺序应该为________________。
(6)写出保险粉和KOH的混合溶液吸收O2的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠
B. 铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应
C. 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金
D. 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com