
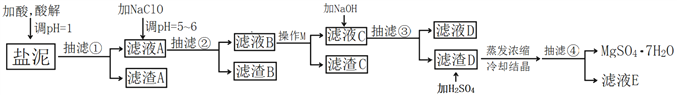
【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:
已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)

根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。
【答案】 硫酸 升温 把盐泥粉碎、搅拌等 Mn2++ ClO-+ H2O == MnO2↓ + 2H++ Cl- 速度快 BaSO4 Fe(OH)3 Al(OH)3 焰色反应 趁热过滤 16.8%(16%、17%均可给分)
【解析】(1)因最终产物为MgSO4·7H2O,所以酸解时应加入硫酸,为加快酸解速率,可采用粉碎、搅拌或适当加热等措施。
(2)已知NaClO可与Mn2+反应产生MnO2沉淀,根据化合价变化规律,则ClO—转化为Cl—,所以反应的离子方程式为Mn2++ ClO-+ H2O == MnO2↓ + 2H++ Cl-。
(3)抽滤操作的优点是过滤速率快;在强酸性条件下过滤得滤渣A,所以其主要成分为BaSO4和CaSO4;在pH=5~6的条件下过滤得滤渣B,根据氢氧化物沉淀完全的pH可知:滤渣B的主要成分为Al(OH)3、Fe(OH)3、MnO2;滤液C中的主要成分为Na2SO4、MgSO4 和少量的CaSO4,其主要杂质阳离子为Na+,可用焰色反应检验。
(4)依据溶解度曲线,CaSO4在40℃左右溶解度最大,在80℃左右溶解度最小,所以操作M应采取的方法适当浓缩、趁热过滤,尽可能多的除去CaSO4。
(5)根据镁元素守恒可得:n(MgSO4·7H2O)= n[Mg(OH)2],所以盐泥中Mg(OH)2的质量分数为= 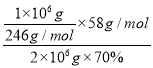 ×100%=16.8%
×100%=16.8%


科目:高中化学 来源: 题型:
【题目】有资料显示过量的 NH3 和 Cl2 在常温下可合成岩脑砂(主要成分为 NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
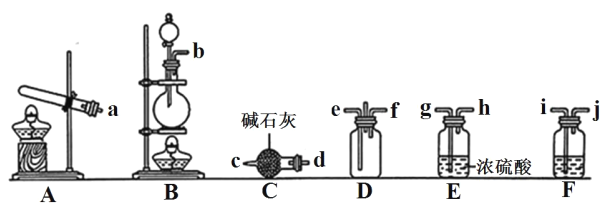
①利用装置 A 制取实验所需的 NH3,写出反应的化学方程式:_______。
②已知该实验中用浓盐酸与 MnO2 反应制取所需 Cl2,装罝 F中的试剂是饱和食盐水,则 F装置的作用是_______。
③为了使NH3和Cl2在D中充分混合,请确定上述装置的合理连接顺序:_______→e f←_______(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明NH3和Cl2反应有岩脑砂生成,需要用到的实验用品中除了蒸馏水、稀 HNO3、 红色石蕊试纸外,还需要用到的试剂有_______。(填试剂的化学式)
(2)岩脑砂中元素的测定
准确称取 a g 岩脑砂,与足量的氧化铜混合加热,利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。(已知该过程发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O)
3Cu+N2↑+2HCl↑+3H2O)
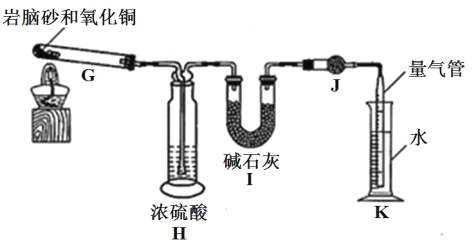
⑤设置装置 H 的目的是______。
⑥若装置 I 增重 b g,利用装置 K 测得气体体积为 V L(已知常温常压下的气体摩尔体积为 24.5L·mol-1),则岩脑砂中 n(N):n(Cl)= ______(用含 b、V的代数式表示,不必化简)。
⑦若测量体积时气体温度高于常温(其他操作均正确),则 n(N)比正常值______ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验题)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)
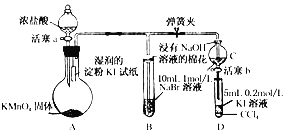
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是____________________
(2)验证氯气的氧化性强于碘的实验现象是____________________
(3)B中溶液发生反应的离子方程式是____________________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________
(5)过程Ⅲ实验的目的是____________________
(6)氯溴碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能力逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是![]()
A. 容器内压强不随时间变化
B. v正(X) =v逆(Z)
C. 容器内X、Y、Z的浓度之比为l:2:2
D. 单位时间内消耗0.1molX的同时生成0.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶体和少量杂质构成的,均属混合物。没有固定的几何外形,所以称为无定形碳,在工业上有着重要用途。回答下列问题:
(1)木炭与硫黄、火硝(硝酸钾)按一定比例混合即为黑火药。黑火药爆炸时生成硫化钾、氮气和二氧化碳。黑火药爆炸的化学方程式为____________。若有15g木炭参加反应,转移电子数为____________。
(2)工业上的炭黑是由烃类裂解而制得的高度分散性的黑色粉末状物质。
①已知几个反应的热化学方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
则由天然气生产炭黑的热化学方程式为____________。
②右图是温度对天然气生产炭黑转化率的影响,下列有关说法正确的是____________。
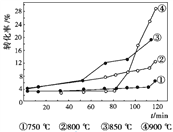
A. 甲烷裂解属于吸热反应
B. 增大体系压强,能提高甲烷的转化率
C. 在反应体系中加催化剂,反应速率增大
D. 升高温度,该反应的平衡常数减小
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1 L密闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=____________ (保留两位小数)。10~20min内,NO的平均反应速率为____________;若30 min后升高温度,达到新平衡时,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,则该反应的ΔH____________0(填“>”、“<”或“=”)。
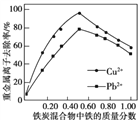
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中span>Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是____________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹):
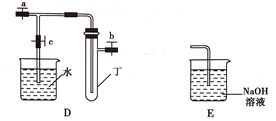
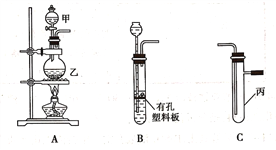
(1)在进行气体制备时,应先检验装置的气密性。将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后__________________________________________,则证明A装置的气密性良好。
(2)利用E装置能吸收的气体有__________________________________(任写两种即可)。
(3)用锌粒和稀硫酸制备H2时应选用装置________作为发生装置(填所选装置的字母序号),实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是___________________________。
(4)某同学将A、C、E装置连接后设计实验比较Cl-和S2-的还原性强弱。
①A中玻璃仪器乙的名称为______________________,A装置中发生反应的离子方程式为
_____________________________________________。
②C中说明Cl-和S2-的还原性强弱的实验现象是_______________________________________。
(5)另一同学将B、D、E装置连接后,在B装置中加入铜片和浓硝酸,制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置中发生反应的离子方程式为________________________________________________。
②反应一段时间后D装置中的具支试管丁中收集满NO2气体,若进行NO2气体与水反应的实验,应____________________________________(填对a、b、c三个止水夹进行的操作),然后再适当加热丁。实验现象为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳循环(如图)对人类生存、发展有着重要的意义。下列说法错误的是
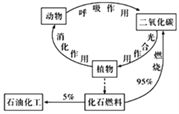
A. 碳是构成有机物的主要元素
B. 石油的年产量是一个国家石油化工发展水平的标志
C. 化石燃料的大量燃烧是产生温室效应的原因之一
D. 光合作用是将太阳能转化为化学能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
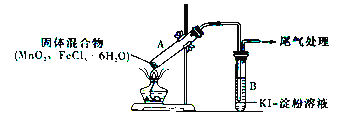
实验操作和现象如下表所示:
实验编号 | 操作 | 现象 |
实验1 | 按上图所示装置加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验2 | 把试管A中的混合物换为FeCl3·6H2O,试管B中溶液换为KSCN溶液,加热 | 试管A中部分固体溶解,产生白雾和黄色气体;试管B中KSCN溶液变红 |
请回答下列问题:
(1)实验1和实验2 产生白雾的原因是_____________________________。
(2)实验2说明黄色气体中含有_____________(填化学式)。
(3)为进一步确认黄色气体中是否含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在试管A、B间增加盛有某种试剂的洗气瓶C,结果试管B 中溶液仍变为蓝色。
方案2:将试管B中KI-淀粉溶液替换为NaBr溶液,结果试管B 中溶液呈橙红色,且未检出Fe2+。则方案1中洗气瓶C 中盛放的试剂是_________;方案2 中检验Fe2+的试剂的名称是______,选择NaBr溶液后试管B中发生的主要反应的离子方程式为______________________________________。
(4)实验1充分加热后,若将试管A中产物分离得到Fe2O3 和MnCl2,则试管A 中产生Cl2 的化学方程式为__________________________________________。其尾气处理的方法是_______________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________________。请你设计实验方案验证此猜想_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com