
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量NO2气体,且起始时体积相同。发生反应:2NO2(g) ![]() N2O4(g) ΔH<0一段时间后相继达到平衡状态。下列说法中正确的是( )
N2O4(g) ΔH<0一段时间后相继达到平衡状态。下列说法中正确的是( )

A.平衡时NO2体积分数:甲<乙
B.乙比甲先达到平衡状态
C.该反应的平衡常数表达式![]()
D.NO2的平衡转化率:甲<乙
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】燃烧1g乙炔(C2H2)生成二氧化碳和液态水,放出热量50kJ, 则这一反应的热化学反应方程式为( )
A. 2C2H2(g)+ 5O2(g) ═4CO2(g)+ 2H2O(l) ΔH= +50kJ/mol
B. C2H2(g)+ 5/2O2(g)═2CO2(g)+ H2O(l) ΔH= +1300kJ/mol
C. 2C2H2+ 5O2═4CO2+ 2H2O ΔH=-2600kJ
D. 2C2H2(g)+ 5O2(g)═4CO2(g)+ 2H2O(l) ΔH=-2600kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 可用作食盐的抗结剂,高温下
可用作食盐的抗结剂,高温下![]() 会分解生成
会分解生成![]() 、KCN、
、KCN、![]() 、
、![]() C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______;
C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______;![]() 中,铁原子不是采用
中,铁原子不是采用![]() 杂化的理由是______。
杂化的理由是______。
(2)![]() 气态为单分子时,分子中S原子的杂化轨道类型为______,分子的立体构型为______;
气态为单分子时,分子中S原子的杂化轨道类型为______,分子的立体构型为______;![]() 的三聚体环状结构如图1所示,该结构中
的三聚体环状结构如图1所示,该结构中![]() 键长有a、b两类,b的键长大于a的键长的可能原因为______。
键长有a、b两类,b的键长大于a的键长的可能原因为______。

(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大![]() 键表示为
键表示为![]() 。
。
①下列微粒中存在“离域![]() 键”的是______;
键”的是______;
A.![]()
![]()
![]()
![]()
②![]() 分子中大
分子中大![]() 键可以表示为______;
键可以表示为______;
(4)铁、钾两种单质的堆积方式剖面图分别如图2、图3所示。铁晶体中原子的空间利用率为______![]() 用含
用含![]() 的式子表示
的式子表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
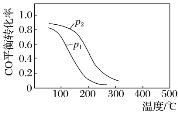
【题目】(1).用合成气生成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH________(填“>”“<”或“= ”)0。
②写出一条可同时提高反应速率和CO转化率的措施:________________________。
③下列说法正确的是________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=__________________。
⑤ 200 ℃时,该反应的平衡常数K=________。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡________(填“正向”“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) ΔH< 0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
2Z(g) ΔH< 0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v正)
C.其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少
D.保持其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3达到平衡状态
2NH3达到平衡状态
A.1个N≡N键形成的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气主要含有CO2、CO、SO2、NOx等物质,逐渐成为城市空气主要污染源。
(1)写出CO2的电子式_____________;CO2带来的主要环境问题是________。
(2)汽车尾气中的CO来自于________________,NO来自于_________________。
(3)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式___________________。
(4)在适宜温度下采用合适催化剂,CO和NO相互反应生成参与大气循环的无毒气体。写出反应化学方程式_______________。
(5)在催化剂作用下,可用氨气将NO和NO2转化为无毒气体,写出NO2和NH3反应生成无毒气体的化学方程式______________。
(6)当燃油中含硫量较高时,尾气中SO2在O2作用下与氨气形成(NH4)2SO4,用化学方程式表示(NH4)2SO4的形成_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的说法不正确的是
A.高炉炼铁、生产普通硅酸盐水泥和普通玻璃都要用到的一种原料是石灰石
B.工业上常以电解饱和食盐水为基础制取氯气
C.纯碱在玻璃、肥皂、食品等工业中有着广泛的应用
D.工业上利用焦炭与二氧化硅在高温下反应可直接制得高纯度的硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是( )
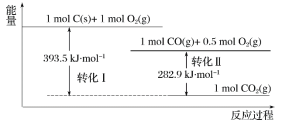
A.1molC(g)与1molO2(g)的能量之和为393.5kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量
C.由C→CO的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-221.2kJ·mol-1
D.热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com