
A、甲烷的电子式: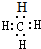 |
B、氮原子的L层电子的电子排布图 |
| C、硫离子的核外电子排布式1s22s22p63s23p4 |
| D、根据价电子对互斥理论,H3O+的空间构型为三角锥形 |
| 1 |
| 2 |
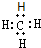 ,故A正确;
,故A正确;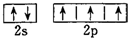 ,故B正确;
,故B正确;| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、一定条件下,2mol SO2与足量O2反应可得到2mol SO3 |
| B、含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C、10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09mol SO2 |
| D、一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
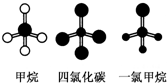
| A、CH4、CCl4和CH3Cl都是正四面体结构 |
| B、CH4、CCl4都是正四面体结构 |
| C、CH4和CCl4中的化学键完全相同 |
| D、CH4、CCl4的结构相同,性质也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1.12L氦气所含原子数为0.1NA |
| B、1.6gNH2-离子所含质子数为NA |
| C、22.4LHCI溶于水,溶液中H数为NA |
| D、9gD2O所含的中子数为4.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH2=CH2+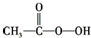 (过氧乙酸)→ (过氧乙酸)→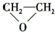 +CH3COOH +CH3COOH | ||
B、CH2=CH2+Cl2+Ca(OH)2→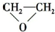 +CaCl2+H2O +CaCl2+H2O | ||
C、2CH2=CH2+O2
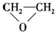 | ||
D、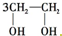
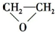 +HOCH2CH2-O-CH2CH2OH+2H2O +HOCH2CH2-O-CH2CH2OH+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、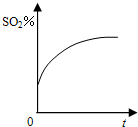 |
C、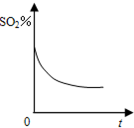 |
D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com