
【题目】下列热化学方程式书写正确的是(△H的绝对值均正确)( )
A.C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
B.C2H5OH+3O2═2CO2+3H2O△H=﹣1368.8KJmol﹣1(反应热)
C.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=﹣114.6KJmol﹣1(中和热)
D.2H2O(g)═2H2(g)+O2(g)△H=+483.6KJmol﹣1(反应热)
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,可行的是( )
A. 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法正确的是( )
不纯物质 | 除杂试剂 | 分离方法 | |
A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C | 苯(Br2) | KOH溶液 | 分液 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素和硼族元素在生产生活中有很重要的地位.
(1)写出硼族元素Ga的基态原子核外电子排布式
(2)NF3的分子构型为 , NO3﹣的空间构型为 , 1mol NO3﹣中含有的σ键的数目为: .
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质.BN的晶体结构与金刚石相似,其中B原子的杂化方式为
(4)元素第一电离能的大小:As(填“<”“>”或“=”)Ga,原因是 .
(5)相同条件下,在水中的溶解度:NH3(填“<”“>”或“=”)PH3 , 原因是 .
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm.则砷化镓的化学式为 , 晶胞中As原子和它最近的Ga原子之间的距离为pm(用含c的式子表示),砷化镓的密度为gcm﹣3(设NA为阿伏伽德罗常数的值,用含c、NA的式子表示,原子量:Ga﹣70,As﹣75). 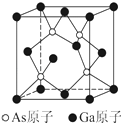
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4gNaOH和10.6gNa2CO3混合并配成溶液,向溶液中滴加0.1mol﹒L﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. 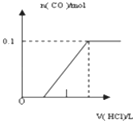 B.
B. 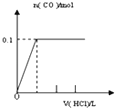
C. 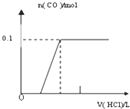 D.
D. 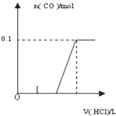
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( ) 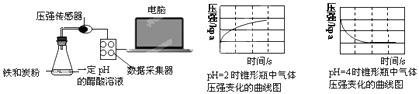
A.溶液pH≤2时,生铁发生析氢腐蚀
B.生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍
C.在酸性溶液中生铁可能发生吸氧腐蚀
D.两溶液中负极反应均为:Fe﹣2e﹣═Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有____性。
(3)己知下列反应: ①2I-+2Fe3+=2Fe2+ +I2 ②2Fe2++H2O2+2H+=2Fe3++2H2O, 则Fe3+ 、I2 、H2O2三者的氧化性由强到弱为____________________________。
(4)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现的性质为_______ ,毎有1 molFe参加反应转移电子_____________mol。
(5)用双线桥标出该反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O电子转移的数目和方向______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题。
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是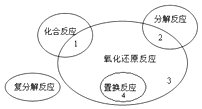
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3
D.CH4+2O2CO2+2H2O
(2)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O
①其中还原剂 , 还原产物是 .
②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为 , 转移电子的物质的量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E、F、G在元素周期表中的位置如图1所示,回答下列问题: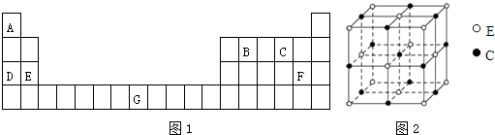
(1)G的基态原子核外电子排布式为 . 原子的第一电离能:DE(填“>”或“<”).
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l﹣l>l﹣b>b﹣b(l为孤对电子对,b为键合电子对),则关于A2C中的A﹣C﹣A键角可得出的结论是 .
A.180°
B.接近120°,但小于120°
C.接近120°,但大于120°
D.接近109°28′,但小于109°28′
(3)化合物G(BC)5的熔点为﹣20℃,沸点为103℃,其固体属于晶体,该物质中存在的化学键类型有 , 它在空气中燃烧生成红棕色氧化物,反应的化学方程式为 .
(4)化合物BCF2的立体构型为 , 其中B原子的杂化轨道类型是 , 写出两个与BCF2具有相同空间构型的含氧酸根离子 .
(5)化合物EC的晶胞结构如图2所示,晶胞参数a=0.424nm.每个晶胞中含有个E2+ , 列式计算EC晶体的密度 gcm﹣3 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com