
【题目】草酸(H2C2O4)是一种二元弱酸,在菠菜、苋菜、甜菜等植物中含量较高。25℃时,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX [X表示 ![]() 或
或![]() 随pH的变化关系如图所示。下列说法不正确的是 ( )
随pH的变化关系如图所示。下列说法不正确的是 ( )
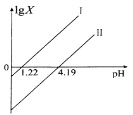
A.直线I中X表示的是![]()
B.直线I、Ⅱ的斜率均为1
C.0.1mol/ L NaHC2O4溶液中:c(Na+)>c(HC2O4-)> c(C2O42-)> c(H2C2O4)
D.已知:25℃时,NH3·H2O的电离常数为10-4.69,则(NH4)2C2O4溶液呈碱性
【答案】D
【解析】
二元弱酸的电离平衡常数Ka1>Ka2,直线Ⅰ表示X与c(H+)乘积等于1×10-1.22,则H2C2O4溶液的Ka1=1×10-1.22,直线Ⅱ表示X与c(H+)乘积等于1×10-4.19,则H2C2O4溶的Ka2=1×10-4.19。
A.直线Ⅰ表示X与c(H+)乘积等于1×10-1.22,平衡常数K=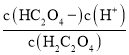 ,与题意不符,A不选;
,与题意不符,A不选;
B.图象中直线Ⅰ表示X与c(H+)乘积等于1×10-1.22,直线Ⅱ表示X与c(H+)乘积等于1×10-4.19,斜率均为1,与题意不符,B不选;
C.HC2O4-的电离平衡常数=1×10-4.19,HC2O4-的水解平衡常数K=![]() =10-12.78,电离程度大于其水解程度,溶液显酸性,则c(Na+)>c(HC2O4-)> c(C2O42-)> c(H2C2O4),与题意不符,C不选;
=10-12.78,电离程度大于其水解程度,溶液显酸性,则c(Na+)>c(HC2O4-)> c(C2O42-)> c(H2C2O4),与题意不符,C不选;
D. 已知:25℃时,NH3·H2O的电离常数为10-4.69,HC2O4-的电离平衡常数=1×10-4.19,HC2O4-电离程度大于NH3·H2O的电离程度,(NH4)2C2O4为相对的强酸弱碱盐,溶液显酸性,符合题意,D可选;
答案为D。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2Cr2O4。考虑到胶体的吸附作用使Na2Cr2O4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图1),使浆液分离成固体混合物和含铬元素溶液,并回收利用。

固体混合物的分离和利用的流程图如图2所示(流程图中的部分分离操作和反应条件未标明):

(1)反应①所加试剂NaOH的电子式为___,B→C的反应条件为___,C→Al的制备方法称为___。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有___(填序号)。
a.温度 b.Cl-的浓度 c.溶液的酸度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下体积为1mL、浓度均为![]() 的XOH和
的XOH和![]() 溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是
溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是![]()
![]()
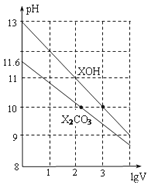
A.![]() 的两种溶液中的
的两种溶液中的![]() 大于
大于![]()
B.已知常温下,![]()
![]()
![]() 溶液的
溶液的![]() ,则
,则![]()
![]()
C.![]() 的二级电离平衡常数
的二级电离平衡常数![]() 约为
约为![]()
D.升高温度![]() 溶液的pH增大,XOH溶液pH减小
溶液的pH增大,XOH溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,![]() 的
的![]() 和
和![]() 的
的![]() 两种碱溶液,起始时的体积均为
两种碱溶液,起始时的体积均为![]() ,分别向两溶液中加水进行稀释,所得曲线如图所示
,分别向两溶液中加水进行稀释,所得曲线如图所示![]() 表示溶液的体积
表示溶液的体积![]() ,
,![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
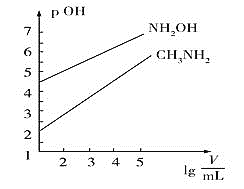
A.![]() 的电离常数
的电离常数![]() 的数量级为
的数量级为![]()
B.用相同浓度的盐酸分别滴定上述两种碱溶液至![]() ,消耗盐酸体积:
,消耗盐酸体积:![]()
C.当两溶液均稀释至![]() 时,溶液中水的电离程度:
时,溶液中水的电离程度:![]()
D.浓度相同的![]() 和
和![]() 的混合溶液中离子浓度大小关系:
的混合溶液中离子浓度大小关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨水中存在电离平衡NH3·H2O![]() NH4++OH-,下列叙述不正确的是( )
NH4++OH-,下列叙述不正确的是( )
A.氨水中离子浓度的关系满足:c(OH-)=c(H+)+c(NH4+)
B.0.10mol/L的NH3·H2O溶液加水稀释,溶液中c(H+)减小
C.NH3·H2O溶液中加少量的NH4Cl固体,平衡逆向移动
D.常温下pH=2的盐酸溶液与pH=12的NH3·H2O溶液等体积混合后,溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯并(a)芘是一种致癌物、致畸源及诱变剂,也是多环芳烃中毒性最大的一种强致癌物。苯并(a)芘的结构简式如图所示,下列有关苯并(a)芘的说法中不正确的是( )
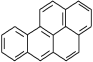
A. 苯并(a)芘的分子式为C20H12,属于稠环芳香烃
B. 苯并(a)芘与![]() 互为同分异构体
互为同分异构体
C. 苯并(a)芘在一定条件下可以发生取代反应,但不能使酸性KMnO4溶液褪色
D. 苯并(a)芘不易溶于水,易溶于苯、氯仿等有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LNaA溶液中逐滴滴加盐酸,测得混合溶液的pH与![]() 变化关系如图所示p
变化关系如图所示p![]() =-lg
=-lg![]() 。下列叙述错误的是
。下列叙述错误的是

A. E点溶液中c(Na+)=c(A-)
B. Ka(HA)的数量级为10-4
C. 滴加过程中![]() 保持不变
保持不变
D. F点溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成原电池——燃料电池,该电池放电时发生的反应为CH4+2KOH+2O2===K2CO3+3H2O,下列说法错误的是( )
A. 通甲烷的一极为负极,通氧气的一极为正极
B. 放电时,通入O2一极附近溶液的pH升高
C. 放电一段时间后,KOH的物质的量不发生变化
D. 通甲烷极的电极反应式是:CH4+10OH--8e-===CO32-+7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com