
【题目】在其他条件不变时,改变某一条件对aA(g)+bB(g)![]() cC(g)化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
cC(g)化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
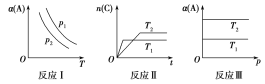
(1)在反应Ⅰ中,若p1>p2,则此正反应为___(填“吸热”或“放热”)反应,也是一个气体分子数____(填“减小”或“增大”)的反应,由此判断,此反应自发进行必须满足的条件是___。
(2)在反应Ⅱ中,T1______T2(填“>”“<”或“=”),该正反应为______(填“吸热”或“放热”)反应。
(3)在反应Ⅲ中,若T1>T2,则该正反应能否自发进行?_________。
【答案】放热 减小 低温 < 放热 能自发进行
【解析】
(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,△H<0;恒定温度时压强越大,α(A)越大,说明此a+b>c,即为熵减反应,△S<0;放热、熵减反应只能在低温下自发进行;
(2)“先拐先平数值大”T2温度下反应先达到平衡状态,说明T2>T1,温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应;
(3)恒温下压强变化对α(A)没有影响,说明a+b=c,△S≈0,若T1>T2,恒压下温度越高α(A)越大,说明升高温度平衡向右移动,正反应为吸热反应,△H>0,则△H-T△S>0,反应不能自发进行。
(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,则正反应为放热反应,△H<0;由p1>p2知恒定温度时压强越大,α(A)越大,即增大压强平衡向右移动,说明此反应为气体分子数减少的反应(a+b>c),即为熵减反应,△S<0,放热、熵减反应只能在低温下自发进行。
故答案为:放热;减小;低温。
(2)反应Ⅱ中T2温度下反应先达到平衡状态,说明T2>T1;温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0。
故答案为:<;放热;
(3)反应Ⅲ中在恒温下压强变化对α(A)没有影响,说明压强变化不能影响平衡,此反应为气体分子数不变的反应(a+b=c),反应过程中熵变很小,△S≈0,若T1>T2,恒压下温度越高A的体积分数越大,说明升高温度平衡向左移动,正反应为放热反应,△H<0,则△H-T△S<0,反应能自发进行。
故答案为:能自发进行。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )

A. 阴极与阳极产生的气体体积比为1:2 B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
下列物质组别中①互为同位素的是___(填组别选项,下同);②互为同素异形体的是___;③互为同分异构体的是___;④属于同一物质的是___;⑤属于同系物的是___。
A.冰与水B.H2、D2、T2C.O2与O3D.![]() K与
K与![]() KE.CH3—CH2—CH2—CH3与
KE.CH3—CH2—CH2—CH3与 F.
F. 与
与 G.甲烷和庚烷
G.甲烷和庚烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气。将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是
选项 | X溶液 | 现象 |
|
A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
D | 紫色石蕊溶液 | 溶液先变红后褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
A. BOH溶于水,其电离方程式是BOH===B++OH-
B. 若一定量的上述两溶液混合后pH=7,则c(A-)=c(B+)
C. 在0.1 mol/L BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+)
D. 若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH=9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如下图所示。

请回答下列问题:
(1)电极X的材料是___________,电解质溶液Y是___________;
(2)银电极为电池的___________极,发生的电极反应为___________;X电极上发生的电极反应为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】心脑血管疾病是一种致残率高的疾病,由于没有明显的临床症状,因而被称为“沉默的疾病”,人类健康的第一杀手。下图是合成一种治疗心脑血管疾病药物路线中的某一步骤,下列说法中正确的是( )
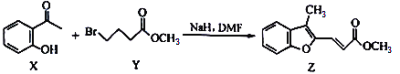
A. Y的分子式为C5H10BrO2
B. X的同分异构体中,含有苯环和羧基的结构共有4种
C. X中所有原子可能在同一平面上
D. 1mol Z最多可与6mol H2发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com