


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、向胶体中加入蔗糖溶液,产生聚沉现象 |
| B、可见光透过胶体时,发生丁达尔现象 |
| C、用渗析的方法“净化”胶体时,使用的半透膜只能让分子、离子通过 |
| D、胶体能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示实验装置制取乙酸乙酯.回答以下问题:
用如图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:查看答案和解析>>
科目:高中化学 来源: 题型:
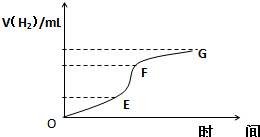 ( I)用纯净的锌粒与100mL2mol/L稀盐酸反应制取氢气,请回答:
( I)用纯净的锌粒与100mL2mol/L稀盐酸反应制取氢气,请回答:| 催化剂 |
| 500℃ |
| SO2 | O2 | SO3 | |
| 反应开始时的浓度/mol?L-1 | 3.0 | 1.5 | 0 |
| 10min后的浓度/mol?L-1 | |||
| 平均反应速率/mol?L-1?min-1 | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com