
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,其中只有C为金属元素。A、C原子序数之和等于E的原子序数,D与B同主族且D原子序数是B原子序数的2倍。AB2和DB2溶于水得到酸性溶液,C2D溶于水得到碱性溶液。
(1)E元素在周期表中的位置为_______________;工业上制取C 单质的化学方程式为______。
(2)A的最低负价氢化物的空间构型为___;C、D、E 的简单离子的离子半径由大到小的顺序是__(用离子符号表示)。
(3)化合物C2D3中,该化合物的水溶液在空气中久置后变质,生成一种单质,所得溶液呈强碱性,用化学方程式表示这一变化过程____________________。
【答案】第三周期ⅦA族 2NaCl![]() 2Na+Cl2↑ 正四面体 S2- >Cl- >Na+ Na2S3 + O2 + 2H2O = 4NaOH + 6S↓
2Na+Cl2↑ 正四面体 S2- >Cl- >Na+ Na2S3 + O2 + 2H2O = 4NaOH + 6S↓
【解析】
A,B,C,D,E五种短周期元素(稀有气体除外),原子序数依次增大,D与B同主族且D原子序数是B原子序数的2倍,则D为S元素,B为O元素,E为Cl元素;只有C为金属元素,化合物C2D溶于水得到碱性溶液,则C只能为Na元素,硫化钠水解生成氢氧化钠,溶液显碱性;A、C原子序数之和等于E的原子序数,则A的原子序数为6,A为C元素;据此分析解答。
根据上述分析,A为C元素、B为O元素、C为Na元素、D为S元素、E为Cl元素。
(1)E为Cl,在周期表中位于第三周期ⅦA族,工业上通过电解熔融的NaCl制取金属钠,反应的方程式为2NaCl![]() 2Na+Cl2↑,故答案为:第三周期ⅦA族;2NaCl
2Na+Cl2↑,故答案为:第三周期ⅦA族;2NaCl![]() 2Na+Cl2↑;(2)A的最低负价氢化物为甲烷,空间构型为正四面体;一般而言,电子层数越多,离子半径越大,则钠离子半径最小,S2- 、Cl-具有相同的电子层结构,离子半径S2- >Cl- ,因此C、D、E 的简单离子的离子半径由大到小的顺序为S2- >Cl- >Na+,故答案为:正四面体;S2- >Cl- >Na+;
2Na+Cl2↑;(2)A的最低负价氢化物为甲烷,空间构型为正四面体;一般而言,电子层数越多,离子半径越大,则钠离子半径最小,S2- 、Cl-具有相同的电子层结构,离子半径S2- >Cl- ,因此C、D、E 的简单离子的离子半径由大到小的顺序为S2- >Cl- >Na+,故答案为:正四面体;S2- >Cl- >Na+;
(3)化合物Na2S3的水溶液在空气中久置后变质,生成硫和氢氧化钠,反应的化学方程式为Na2S3 + O2 + 2H2O = 4NaOH + 6S↓,故答案为:Na2S3 + O2 + 2H2O = 4NaOH + 6S↓。


科目:高中化学 来源: 题型:
【题目】短周期主族元素 Q、W、X、Y、Z原子序数依次增加,其中Q、W原子核外L 电子层的电子数分别为0、4,X、Y、Z在周期表中的位置如图所示。 下列说法不正确的是
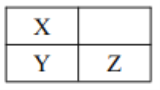
A. W、 X、 Q 的原子半径依次减小 B. Y 的最高价氧化物的水化物一定是强酸
C. W 和 Z 可能形成化合物W3Z8 D. Q、 X、 Z 可能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于2X(g)![]() Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。
Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态)。

(1)该反应的正反应方向是一个________反应(“吸热”或“放热”)。
(2)A、B、C、D、E各状态中,v正<v逆的点是____________。
(3)维持t1不变,E→A所需时间为x,维持t2不变,D→C所需时间为y,则x ______ y(填“<”、“>”或“=”)。
(4)欲使E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4FeSO46H2O↓。其流程可表示为:
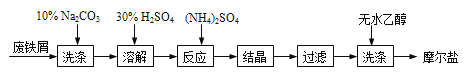
(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
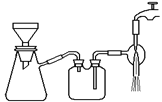
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
A.酚酞 | B.甲基橙 | C.石蕊 | D.不需要 |
②产品中Fe2+的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~H均为中学化学常见的物质,转化关系如下图。其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、F、G、H的焰色反应均为黄色,E为两性化合物。

(1)写出C与水反应的离子方程式_____________________________________,假设温度不变,该反应会使水的电离程度________(填写“变大”“变小”“不变”)
(2)B的水溶液呈_________性,用离子方程式解释原因______________
(3)将A~H中易溶于水的化合物溶于水,会抑制水的电离的是____________(填序号)
(4)常温下,pH均为10的D、F溶液中,水电离出的c(OH-)之比为___________________向D的稀溶液中通入CO2至溶液呈中性,所得溶液中离子物质的量浓度由大到小的顺序为:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果,下列图像描述正确的是

A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,且甲的压强大
3C(g)+D(g)的影响,且甲的压强大
C. 图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系
D. 图④表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)按要求完成下列填空
Ⅰ.已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l) ΔH=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的ΔH= ;
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH>0
CO2(g)+ H2(g) ΔH>0
①下列事实能说明该反应达到平衡的是 ;
a.体系中的压强不发生变化
b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②在某温度下,反应物的起始浓度分别为:c(CO)=" 1" mol·L-1, c(H2O)="2.4" mol·L-1; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是 ;
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式 。
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
SiO2 + C + N2![]() Si3N4 + CO 根据题意完成下列各题:
Si3N4 + CO 根据题意完成下列各题:
(1)配平上述化学反应方程式。 SiO2 + C + N2![]() Si3N4 + CO
Si3N4 + CO
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30mol氮气,反应生成了5mol一氧化碳,则此时混合气体的平均摩尔质量是 。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是 。
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备 |
B.在电子工业上制成耐高温的电的良导体 |
C.研发氮化硅的全陶发动机替代同类型金属发动机 |
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2+ O2![]() 2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,SO2的转化率为90%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com