
【题目】下列有关说法正确的是
A.反应![]() 在任何条件下都不会自发进行
在任何条件下都不会自发进行
B.溶液![]() 加水稀释后,溶液中
加水稀释后,溶液中 的值减小
的值减小
C.温度升高,反应物的活化分子数增多,主要因素是分子的运动加快,反应速率加快
D.![]() 液中加入少量
液中加入少量![]() 固体,
固体,![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述正确的是
A.合成氨生产中将![]() 液化分离,可增大反应速率,提高
液化分离,可增大反应速率,提高![]() 、
、![]() 的转化率
的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用![]() 转化为
转化为![]() 时放出的热量
时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的![]() 进入阳极室
进入阳极室
D.侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于哪类物质?____、____、___。
(2)请写出铜绿与盐酸反应的化学方程式________。
(3)写出B的化学式___________。
(4)上述转化过程中属于化合反应的是________,属于分解反应的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的现象和结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 测定等浓度的 |
| 非金属性: |
B | 将稀硫酸加入到碳酸钙中,排饱和食盐水收集气体 | 收集到一定量气体 | 实验室可用此法制备 |
C | 将4mL |
| 增大反应物浓度, 反应速率加快 |
D | 将 | 溶液变红 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量;1 mol CH4 完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写中正确的是( )
A. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=890.3 kJ·mol-1
B. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ·mol-1
C. CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3 kJ
D. 2H2(g)+O2(g)===2H2O(l)ΔH=-517.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的某容积不变的密闭容器中,建立下列化学平衡 C(s)+H2O(g)![]() CO(g)+H2(g),下列叙述中不能说明上述可逆反应已达到化学平衡状态的是
CO(g)+H2(g),下列叙述中不能说明上述可逆反应已达到化学平衡状态的是
A.体系的压强不再发生变化B.气体密度不再改变
C.生成n mol CO的同时生成n mol H2D.1 mol H–H键断裂的同时断裂2 molH–O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的密闭容器中,用两种不同方法制得的![]() 分别进行催化分解水的实验:
分别进行催化分解水的实验:![]()
![]() ,水蒸气的浓度
,水蒸气的浓度![]() 随时间
随时间![]() 变化如表所示。
变化如表所示。
序号 |
a克 | 温度
| 0 | 10 | 20 | 30 | 40 | 50 |
① | 方法I |
|
|
|
|
|
|
|
② | 方法 |
|
|
|
|
|
|
|
③ | 方法II |
|
|
|
|
|
|
|
下列叙述正确的是
A.实验①前20min的平均反应速率![]()
B.实验①比实验②所用的![]() 催化效率高
催化效率高
C.实验的温度:![]()
D.实验①、②、③的化学平衡常数的关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
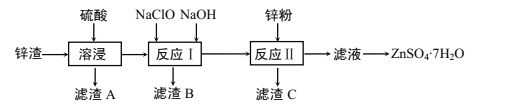
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com