
【题目】丁香酚存在于丁香花的花蕊中,以丁香酚为原料制取有机物 F 的路线如下:
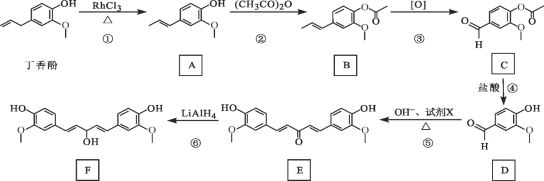
已知:![]()
(1)丁香酚的分子式为_______。
( 2) A 中的含氧官能团是_______( 填名称), ② 的反应类型为_______。
(3)写出满足下列条件的 C 的所有同分异构体的结构简式_______。
①含苯环且环上只有两个取代基;
②属于酯类化合物;
③核磁共振氢谱有 3 组峰,且峰面积之比为 3∶1∶1。
(4)1 mol D 最多可以与_______molH2 发生加成反应。
(5)反应⑤中,试剂 X 的结构简式为_______。
(6)设计用呋喃甲醛( ![]() )和环己醇为原料制
)和环己醇为原料制 ![]() 的合成路线_______(无机试剂任选)。
的合成路线_______(无机试剂任选)。
【答案】C10H12O2 羟基、醚键 取代反应 ![]() 、
、![]() 4
4 ![]()

【解析】
(1)根据有机物的键线式书写分子式;(2)根据有机物的结构简式分析官能团的种类,根据有机反应的结构变化判断反应类型;(3)根据有机物的分子式及限制条件书写同分异构体;(4)根据双键与苯环的加成反应分析解答;(5)根据反应物和生成物的结构变化判断另一种反应物;(6)由反应产物和原料、题干进行对比,设计合成路线。
(1)根据丁香酚的键线式,可知其分子式为C10H12O2,故答案为:C10H12O2;
(2)从A的键线式判断该有机物的官能团为碳碳双键、羟基和醚键,含氧官能团只有羟基和醚键;根据A. B两种有机物的结构对比,结合另一反应物为(CH3CO)2O,从羟基变成酯基,得出该反应为取代反应,故答案为:羟基、醚键;取代反应;
(3)C的分子式为C10H10O4,根据信息中含有苯环,则取代基只剩下4个碳原子,且苯环上有两个取代基,其相对位置应该有邻位、间位和对位三种结构。又因其核磁共振氢谱为3组峰,峰面积比为3:1:1,它可能的同分异构体应该是邻位的两个相同的取代基,因为C是酯类化合物,故取代基为COOCH3或者OOCCH3,可以确定符合条件C的同分异构体结构简式为![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;
(4)由D的结构简式可知,其分子中含有一个醛基,1分子醛基可以加成1分子H2,另外1分子苯环也可以加成3分子H2,1molD最多可以与4molH2发生加成反应,故答案为:4;
(5)反应⑤的条件与题给已知反应对应,对比D、 E的结构,发现E比2个D多了中间的三个碳原子,可以得出试剂X为![]() ,故答案为:
,故答案为:![]() ;
;
(6)由反应产物和原料、题干进行对比,可以得出该流程利用题给已知信息的反应。所以应先把环己醇转化为环己酮,再与![]() 进行反应,根据题干中反应⑥的转化,为了保护碳碳双键,使用LiAlH4还原得到目标产物而不是用H2进行加成,合成路线流程图为:
进行反应,根据题干中反应⑥的转化,为了保护碳碳双键,使用LiAlH4还原得到目标产物而不是用H2进行加成,合成路线流程图为: ,故答案为:
,故答案为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有物质的量浓度均为![]() 的8种溶液:
的8种溶液:
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)![]() 由小到大的顺序为______________________________________(填序号)。
由小到大的顺序为______________________________________(填序号)。
(2)取两种溶液等体积混合,充分反应后溶液呈中性,则这两种溶液是_________________(填溶质的化学式,下同)。
(3)若上述溶液的体积均为![]() ,加水稀释至
,加水稀释至![]() ,
,![]() 的溶液是____________________。若要使
的溶液是____________________。若要使![]() 溶液的
溶液的![]() ,则应该加入
,则应该加入![]() 溶液的体积为____________________。
溶液的体积为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A在催化剂作用下加压、加热与水反应制得B,B在一定条件下氧化可得C,C在催化剂作用下与氧气反应可得D,D和B与浓硫酸混合加热可得到有香味的无色油状液体E。它们的转化关系如下:

请回答下列问题:
(1)推断下列物质: A_________,B __________,C __________,D__________,E_________; (写结构简式)
(2)写出下列反应方程式并指出反应类型。
①A→B:___________________________________________;属_________反应;
②D+B→E:___________________________________________;属_________反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池具有比能量高、无污染的特点,用下图模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是( )
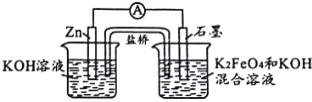
A.放电时,电子由正极通过外电路流向负极
B.放电时,负极上的电极反应式为:Zn—2e-+2H2O=Zn(OH)2+2H+
C.充电时,阴极区溶液的pH减小
D.充电时,阳极上的电极反应式为:Fe(OH)3—3e-+5OH-=FeO4 2-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%,单宁酸(Ka约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示:

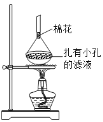
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
(2)提取过程不可选用明火直接加热,原因是__________,与常规的萃取相比,采用索氏提取器的优点是_____。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是______________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是中和______________和吸收________。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示。

(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g)+![]() O2(g)= CO2(g) H=-283.0 kJ/mol
O2(g)= CO2(g) H=-283.0 kJ/mol
S(g)+O2(g)=SO2(g) H=-296.0 kJ/mol
下列说法不正确的是
A.放热反应不一定是自发反应
B.CO2与SO2可以用澄清石灰水鉴别
C.CO2分子中各原子最外层均为8电子稳定结构
D.相同条件下:2CO(g)+SO2(g)=S(g)+2CO2 (g) H=-270kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备

(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。

(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是
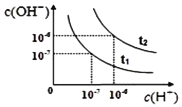
A.t1<t2
B.将t1温度下0.1 mol·L1的盐酸稀释,溶液中所有离子的浓度均相应减小
C.一定温度下,改变水溶液中c(H+)或 c(OH)的浓度,Kw不会发生变化
D.t2温度pH为2的HCl溶液中,水电离出的c(H+)=1×1010mol·L1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com