
| A. | NaCl | B. | Na2CO3 | C. | NH4Cl | D. | NaHSO4 |
分析 酸、强酸酸式盐或碱抑制水电离,含有弱离子的盐促进水电离,据此分析解答.
解答 解:A.NaCl是强酸强碱盐,不促进也不抑制水电离,故A错误;
B.碳酸钠是强碱弱酸盐,碳酸根离子水解促进水电离,水的电离平衡正向移动,故B正确;
C.氯化铵是强酸弱碱盐,铵根离子水解而促进水电离,水的电离平衡正向移动,故C正确;
D.硫酸氢钠在水溶液中完全电离,生成氢离子而使溶液呈强酸性,抑制水电离,水的电离平衡逆向移动,故D错误;
故选BC.
点评 本题以盐类水解为载体考查水的电离,为高频考点,明确酸、碱、盐影响水电离原理是解本题关键,易错选项是D,注意硫酸氢钠在水溶液中或熔融状态下电离方式区别,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4分子的球棍模型: | B. | 聚氯乙烯的结构简式为CH2CHCl | ||
| C. | 3,3-二甲基-1-戊烯的键线式: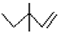 | D. | 乙醇分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液一定显碱性 | B. | 溶液不可能显碱性 | ||
| C. | 溶液可能显碱性 | D. | 溶液不可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ①②③⑥ | C. | ①③④⑤⑦ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com