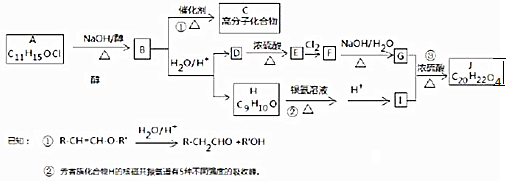
��������Ԫ�أ�����A��B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش����⣮
| Aԭ�ӵĺ���������͵��Ӳ�����ȣ�Ҳ����������ḻ��Ԫ�� |
| BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�
I1=738kJ/mol��I2=1451kJ/mol��I3=7733kJ/mol��I4=10540kJ/mol�� |
| Dԭ�Ӻ�������P���ȫ������� |
| EԪ�ص������������������IJ�Ϊ4 |
| F��ǰ�������е縺����С��Ԫ�� |
| G�����ڱ��ĵ����� |
��1����֪BA
5Ϊ���ӻ����д�������ʽ
��
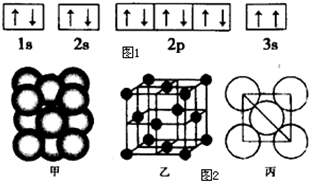
��2��ijͬѧ����������Ϣ���ƶ�C��̬ԭ�ӵĺ�������Ų�Ϊͼ1����ͬѧ�����ĵ����Ų�ͼΥ����
��
��3��G�
��
�����۵����Ų�ʽΪ
��
��4��DE
5����ԭ�ӵ��ӻ���ʽΪ
���ü۲���ӶԻ��������Ʋ�����ӿռ乹��Ϊ
��
��5����ij����������ԭ�ӵĶѻ�������ͼ2����ʾ���侧��������ͼ2����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ2����ʾ�����и�ԭ�ӵ���λ��Ϊ
���þ�����ܶ�Ϊ��
g/cm
3������֪�ý���Ԫ�ص����ԭ������ΪM��ԭ�Ӱ뾶Ϊa nm��

 ��������Ԫ�أ�����A��B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش����⣮
��������Ԫ�أ�����A��B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش����⣮ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
 ����һϵ�з�Ӧ�����ɸ߷ֻ�����H����ת����ϵ��ͼ��ʾ��
����һϵ�з�Ӧ�����ɸ߷ֻ�����H����ת����ϵ��ͼ��ʾ��



 ��B2H6Ϊ�����飩
��B2H6Ϊ�����飩 ����F�Ľṹ��ʽ��
����F�Ľṹ��ʽ��