
【题目】2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是

A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.![]() 的名称为螺[5,4]壬烷
的名称为螺[5,4]壬烷
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体(NiCl2·6H2O)流程如下:
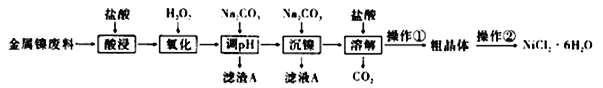
下表列出了相关金属离子生产氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Al(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列问题:
(1)加入H2O2氧化时发生反应的离子方程式为______,调pH的范围为_______,若调pH=6,则溶液中c(Al3+):c(Fe3+)=________。(已知Ksp[Al(OH)3]=1×10-34,Ksp[Fe(OH)3]=1×10-38)
(2)滤液A的溶质主要是_______。
(3)操作①的实验方法依次是_________、冷却结晶、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种无机物之间的转化关系如下图所示(反应条件省略,部分产物省略)。下列推断不正确的是( )

A.若L为强碱,则E可能为NaCl溶液、F为K
B.若L为强酸,则E可能为Na2S、F为H2O2
C.若L为弱酸,则E可能为Mg、F为CO2
D.若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫在生产和生活中有着广泛的用途。
(1)SO2可用来制备定影剂Na2S2O3,,反应的化学方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2↑。请用单线桥表示该反应中的电子转移情况______,还原剂与氧化剂的物质的量之比为____。
(2)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为______;吸收后的浓溶液可用图1的装置再生循环脱硫,并制得硫酸,电极a的电极反应为_____,乙是____。
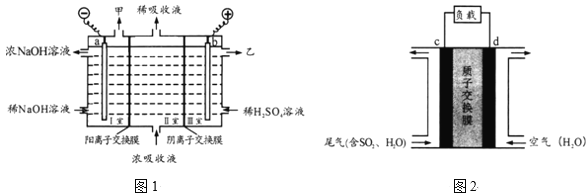
(3)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是______,c电极是__极,移动的离子及方向是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.0g铜与60.0mL一定浓度的硝酸发生如下反应:Cu+4HNO3 = Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O。铜完全溶解产生的混合气体体积为8.96L(标况)。请计算(各数据保留两位有效数字):
(1)NO的体积为______
(2)该混合气体的平均摩尔质量约为______
(3)待产生的气体全部释放后,向溶液加入100mL 2.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,可采取的措施为( )
A.通入二氧化碳气体B.加入氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员利用Cu/ZnO作催化剂,在光照条件下实现了CO2和H2合成CH3OH,该反应历程示意图如下。
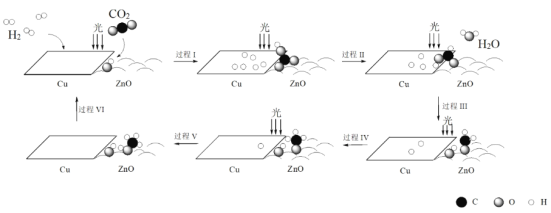
下列说法不正确的是
A.过程I中ZnO表面上进行CO2的吸附与转化
B.过程II中存在极性键的断裂与形成
C.过程V中生成CH3OH时吸收能量
D.总反应的化学方程式是CO2 + 3H2![]() CH3OH + H2O
CH3OH + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_____区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_____,1mol [Co(NH3)5Cl]Cl2中含σ键数目为___ NA。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是______________。![]() 的空间构型是________________,HPO3中心原子的杂化方式是_________________。
的空间构型是________________,HPO3中心原子的杂化方式是_________________。
(3)PH3是_____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是____。
(4)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如下图。S2-的配位数是______;若硫化锂晶体的密度为a g·cm -3,则距离最近的两个S2-的距离是_____nm。(用含 a、M、NA的计算式表示)。
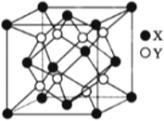
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①![]() O、
O、![]() O、
O、![]() O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥
O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥![]() K、
K、![]() Ca、
Ca、![]() Ar,回答下列问题:
Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)![]() H2
H2![]() O的摩尔质量为____________,相同质量的
O的摩尔质量为____________,相同质量的![]() H2
H2![]() O与
O与![]() H2
H2![]() O所含质子数之比为______,中子数之比为__________。
O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的![]() H2
H2![]() O和
O和![]() H2
H2![]() O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com