
【题目】2019 年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_____区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_____,1mol [Co(NH3)5Cl]Cl2中含σ键数目为___ NA。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是______________。![]() 的空间构型是________________,HPO3中心原子的杂化方式是_________________。
的空间构型是________________,HPO3中心原子的杂化方式是_________________。
(3)PH3是_____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是____。
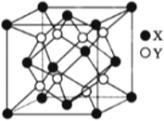
(4)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如下图。S2-的配位数是______;若硫化锂晶体的密度为a g·cm -3,则距离最近的两个S2-的距离是_____nm。(用含 a、M、NA的计算式表示)。
【答案】d 3 21 HPO3 正四面体 sp2 极性 NH3能与水分子形成氢键 8 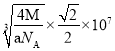
【解析】
(1)Mn位于元素周期表的第四周期第ⅦB族,属于d区。Co元素是27号元素,基态Co原子核外电子排布式为:[Ar]3d74s2,3d上有3个未成对电子。[CoCl (NH3)5]2+中Cl和5个NH3与Co3+之间形成6个配位键,为σ键,每个氨气分子中每个氢原子和氮原子之间形成一个σ键,共6+5×3=21个,所以1mol [CoCl (NH3)5] Cl2 中含σ键数目为21NA,故答案为:d;3;21;
(2)H3PO4、H3PO2、H3PO3、HPO3可改写成(HO)3PO、(HO)2PO、(HO)3P、(HO)PO2,非羟基氧原子个数分别为1、1、0、2,非羟基氧数目越多,酸性越强,则酸性最强的是:HPO3。PO43-的中心原子价层电子对数=![]() =4,采取sp3杂化,且不含孤电子对,所以为正四面体构型。HPO3[(HO)PO2]的中心P原子的价层电子对数=
=4,采取sp3杂化,且不含孤电子对,所以为正四面体构型。HPO3[(HO)PO2]的中心P原子的价层电子对数=![]() =3,采取sp2杂化,故答案为:HPO3;正四面体;sp2;
=3,采取sp2杂化,故答案为:HPO3;正四面体;sp2;
(3)PH3空间构型为三角锥形,P原子位于顶点,所以正负电荷中心不重合,为极性分子,NH3能与水分子形成氢键,而PH3不能,所以PH3在水中的溶解性比PH3小,故答案为:极性;NH3能与水分子形成氢键;
(4)根据均摊法,晶胞中X的个数为![]() =4,Y的个数为8,该晶体的化学式为Li2S,所以X代表S2-,Y代表Li+,根据晶胞结构示意图可知,S2-的配位数为8,距离最近的两个S2-的距离为面对角线的一半,已知晶胞的密度为ag·cm-3,晶胞的质量m=
=4,Y的个数为8,该晶体的化学式为Li2S,所以X代表S2-,Y代表Li+,根据晶胞结构示意图可知,S2-的配位数为8,距离最近的两个S2-的距离为面对角线的一半,已知晶胞的密度为ag·cm-3,晶胞的质量m=![]() g,则晶胞的棱长为
g,则晶胞的棱长为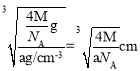 ,所以距离最近的两个S2-的距离为
,所以距离最近的两个S2-的距离为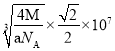 nm,故答案为:8;
nm,故答案为:8;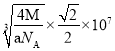 。
。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是

A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.![]() 的名称为螺[5,4]壬烷
的名称为螺[5,4]壬烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定 CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将 CO2转化为 C 和 Li2CO3,充电时选用合适催化剂会释放出 CO2。下列说法正确的是
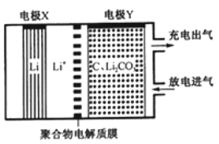
A.该电池放电时,Li+向电极 X 方向移动
B.该电池放电时,每转移 4 mol 电子,理论上生成 1mol C
C.该电池充电时,电极Y 与外接直流电源的负极相连
D.该电池充电时,阳极反应式为:C+2Li2CO3-4e- = 3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W 的原子序数依次增大,X、Y 为有机物中常见元素,Y、Z、W 同周期,由四种元素形成的化合物甲的结构如图。下列说法正确的是
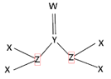
A.最高化合价:W>Z>Y>X
B.蛋白质中一定含有这四种元素
C.(YZ)2 与 X2W2 均为直线型分子
D.化合物甲的一种同分异构体可能既有离子键又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)燃煤发电是能量转换的过程,煤燃烧是由__________能转化为__________能,然后通过蒸汽,再转化为____________能,最后通过发动机,转化为____________能。
(2)火力发电的缺点是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.9molL-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A.0.03molL-1min-1B.1.8molL-1min-1
C.1.2molL-1min-1D.0.18molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质B的质量分数减小了
C.物质A的转化率减小了
D.a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com