
| A、常温常压下,15g甲基(-14CH3)所含的电子数为9NA |
| B、常温下,2L pH=12的Na2CO3溶液中含有的OH-数目为0.02NA |
| C、6.8g液态KHSO4中含有0.1NA个阳离子 |
| D、1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |


科目:高中化学 来源: 题型:
| A、除去乙醇的水:加新制生石灰,蒸馏,收集馏出物 |
| B、检验淀粉的水解产物:在用酸作催化剂的水解液中直接加入新制Cu(OH)2溶液,然后加热,观察是否有红色沉淀生成 |
| C、除去乙酸乙酯中的乙酸:加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
| D、银氨溶液的配制:在洁净的试管中加2% AgNO3溶液1~2mL,逐滴加入2%稀氨水,边滴边振荡,至沉淀恰好溶解时为止 |
查看答案和解析>>
科目:高中化学 来源: 题型:
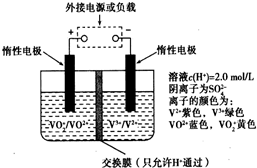 某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )
某电动汽车上使用的新型钒电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.下列有关该钒电池的说法不正确的是( )| A、充电过程中,左槽溶液逐渐由黄变蓝,此时左槽溶液pH值升高 |
| B、放电过程中,H+通过质子交换膜向左移动 |
| C、放电过程中,负极区溶液颜色由紫色变为绿色 |
| D、充电时若转移的电子数为3.01×1024个,左槽溶液中n(H+)增加了5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol?L-1 |
| B、1 mol?L-1 |
| C、2mol?L-1 |
| D、0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池反应的化学方程式为:2Li+FeS═Li2S+Fe |
| B、负极的电极反应式为:Al-3e-=Al3+ |
| C、Li-Al在电池中作为负极材料,该材料中Li的化合价是+1 |
| D、电池充电时,阴极反应为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:
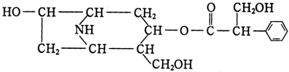
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com