


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 阳离子 | Mg2+、Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
| A、AgNO3 |
| B、Na2SO4 |
| C、MgCl2 |
| D、MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数相等,化学性质与质量数不同 |
| B、原子序数相等,并有相同的化学性质和相同的质量数 |
| C、原子序数相等,化学性质几乎完全相同,而中子数不同 |
| D、化学性质相同,而质量数与原子序数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为五种原子序数逐渐增大的短周期元素,其中 A与B组成的化合物是一种温室气体,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1:1和1:2的两种离子化合物.
A、B、C、D、E为五种原子序数逐渐增大的短周期元素,其中 A与B组成的化合物是一种温室气体,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1:1和1:2的两种离子化合物.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
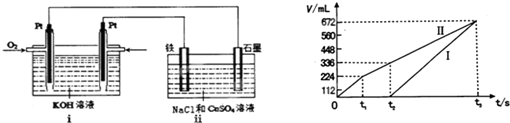
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 现象 |
| ①向苯酚稀溶液中滴加浓溴水 | |
| ②向苯酚溶液中加入FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com