解答:
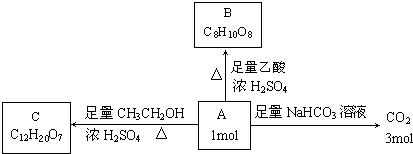
解:A、B、C、D是四种短周期元素,它们的原子序数依次增大.A、D元素同主族,二者形成原子个数1:1型离子化合物,含有金属元素,非金属元素,为ⅠA族元素,D的原子序数至少比A大3,可推知A为H、D为Na,丙为NaH;结合原子序数可知,B、C处于第二周期,A、C形成原子个数1:1的化合物乙为液态,乙应为H
2O
2,则C为O元素;C、D形成原子个数1:1的离子化合物丁为Na
2O
2,B、C形成原子个数1:1的化合物甲为气体,密度略小于空气,甲应为CO,则B为碳元素,
(1)由上述分析可知,丙为NaH,属于离子化合物,电子式为Na
+[:H]
-,丁为Na
2O
2,由过氧根离子与钠离子构成,阴离子与阳离子的个数比为1:2;
故答案为:Na
+[:H]
-;1:2;
(2)标准状况下5.6L CO完全燃烧生成稳定氧化物时放出的热量为QkJ,1molO完全燃烧放出的热量=QkJ×
=4QkJ,则CO燃烧热的热化学方程式为:CO(g)+
O
2(g)=CO
2 (g);△H=-4Q kJ/mol,
故答案为:CO(g)+
O
2(g)=CO
2 (g);△H=-4Q kJ/mol;
(3)B、C两种元素按原子个数比为1:2可形成化合物戊为CO
2,A、C、D三种元素按原子个数比为1:1:1可形成化合物己为NaOH,则己与戊按物质的量之比为3:2完全反应后得到等物质的量Na
2CO
3和NNaHCO
3,溶液中碳酸根离子水解程度大于碳酸氢根离子,水解呈碱性,故溶液中离子浓度:c(Na
+)>c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+),
故答案为:c(Na
+)>c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+);
(4)某同学设计以CH
3OH物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO
4混合溶液,
①ⅰ中通入甲醇一极为负极,碱性条件下生成碳酸根与水,电极反应式为:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O,
故答案为:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O;
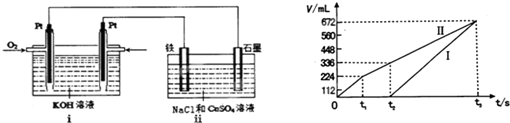
②Fe为阴极,石墨为阳极,开始阳极生成的气体为氯气,阴极为铜离子放电生成Cu,氯离子放电完毕,水放电生成氧气,当溶液中铜离子放电完毕,实质为电解水,阴极是氢离子放电生成氢气,在0~t
1阶段为电解氯化铜溶液,在t
1~t
2阶段为电解硫酸铜溶液,
故在t
1后,石墨电极上的电极反应式为4OH
--4e
-═2H
2O+O
2↑或2 H
2O-4e
-=O
2↑+4 H
+;
在t
2时溶液中铜离子恰好放电完毕,t
1~t
2阶段生成氧气为336mL-224mL=112mL,其物质的量为
=0.005mol,由2 H
2O-4e
-=O
2↑+4 H
+可知,n(H
+)=4n(O
2)=0.005mol×4=0.02mol,则c(H
+)=
=0.1mol/L,则此时溶液pH=-lg0.1=1,
故答案为:4OH
--4e
-═2H
2O+O
2↑或2 H
2O-4e
-=O
2↑+4 H
+;1.



 名校课堂系列答案
名校课堂系列答案