
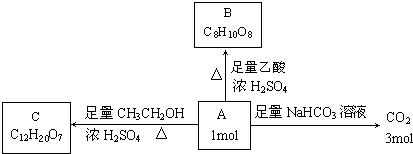
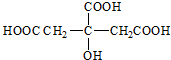
 ,B的结构简式为
,B的结构简式为 ,C的结构简式为
,C的结构简式为 ,据此解答.
,据此解答. ,B的结构简式为
,B的结构简式为 ,C的结构简式为
,C的结构简式为 ,
, ,故答案为:
,故答案为: ;
;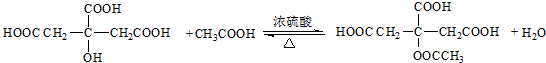 ,
,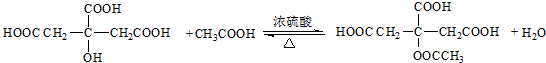 .
.


科目:高中化学 来源: 题型:
| A、NH4NO3溶液呈酸性的原因:NH4++H2O=NH3?H2O+H+ |
| B、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| C、硫酸氢钠溶液中滴加少量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
D、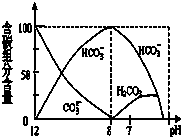 如图是在0.1 mol?L-1Na2CO3溶液中逐滴加入0.1 mol?L-1 HCl,则 pH=7时的离子方程式:H++HCO3-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为五种原子序数逐渐增大的短周期元素,其中 A与B组成的化合物是一种温室气体,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1:1和1:2的两种离子化合物.
A、B、C、D、E为五种原子序数逐渐增大的短周期元素,其中 A与B组成的化合物是一种温室气体,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1:1和1:2的两种离子化合物.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,2.24L H2O2气体中含有的分子数为0.1×6.02×1023 |
| B、46 g NO2和N2O4混合气体中含有原子数为3NA |
| C、100 mL 0.2 mol/L的Fe2(SO4)3溶液中,含有的Fe3+数为0.1×0.2×6.02×1023 |
| D、25℃时,纯水中含有的H+数为1×10-7×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有3个未成对电子 |
| X | 3p能级上有一个空轨道 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 3d能级上只有1对成对电子 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | AgBr | AgI |
| 颜 色 | 白色 | 浅黄色 | 黄色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
| c(Br-) |
| c(Cl-) |
+ 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com