
| 实验 | 现象 |
| ①向苯酚稀溶液中滴加浓溴水 | |
| ②向苯酚溶液中加入FeCl3溶液 |
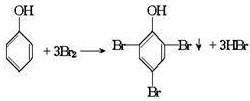 ,
, ;
;
| ||
| ||


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
| A、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ |
| B、氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O |
| C、SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
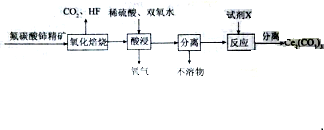
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不含NO3-,可能含Fe3+ |
| B、含有NO3-、I-、Cl- |
| C、含I-,但不能确定是否含Cl- |
| D、不含有NO3-和Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
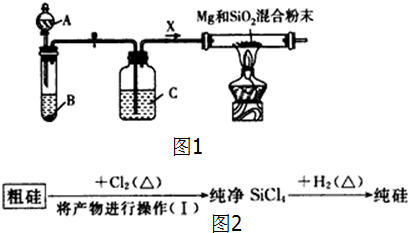
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、49 | B、16 | C、36 | D、42 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com