
【题目】聚合硫酸铁、明矾可用作净水剂。某课题组拟以废弃的铝铁合金为原料制备聚合硫酸铁和明矾,设计化工流程如下:

(1)聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①在聚合硫酸铁中,x、y之间的关系是_______。试剂X中溶质的化学式为________。
②上述流程图中的“氧化”设计存在缺陷,请提出改进意见;____________________为了降低聚合硫酸铁的溶解度,在浓缩过程中加入适量的溶剂是________(填结构简式)。
③加入试剂Y的目的是为了调节溶液的PH,若Y为氧化物,写出调节PH的离子方程式:________;溶液的pH对[Fe2(OH)x(SO4)y]n中x的值有较大影响(如图A所示),试分析pH过小(pH≤3.0)导致聚合硫酸铁中x的值减小的原因:________。

(2)明矾的化学式为KAl(SO4)2·12H2O。图B为明矾的溶解度随温度变化的曲线,由滤液Ⅰ制备明矾晶体的流程如下(供选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):

①试剂1是____;操作1的名称是________。
②结晶措施是________。
【答案】x+2y=6 KOH 将稀硝酸改为双氧水或通入氧气 CH3CH2OH Fe2O3+6H+=2Fe3++3H2O 抑制Fe3+水解 废弃过滤的铝铁合金 蒸发浓缩 冷却或冷却热饱和溶液
【解析】
(1) ①根据化合物中化合价代数和为0分析,有关系式为:x+2y=6。废弃的铝铁合金加入试剂X将铁和铝元素分离,且最后得到明矾,说明加入试剂中含有钾元素,且为碱性,所以试剂X为KOH。② 因为最后得到的物质中不含硝酸根离子,且硝酸反应后会生成有毒气体——氮的氧化物,所以应将稀硝酸改为双氧水或通入氧气。因为聚合硫酸铁能溶于水,微溶于乙醇,为了降低聚合硫酸铁的溶解度,所以在浓缩过程中加入适量的CH3CH2OH。③加入一种氧化剂调节溶液的pH且不引入杂质,则加入氧化铁,离子方程式为:Fe2O3+6H+=2Fe3++3H2O。因为铁离子水解显酸性,pH小会抑制Fe3+水解,使x变小。 (2) 滤液Ⅰ含有氢氧化钾和偏铝酸根离子,所以加入废弃过滤的铝铁合金再次溶解金属铝,然后蒸发浓缩得到偏铝酸钾饱和溶液,再加入硫酸反应生成硫酸铝钾,最后冷却或冷却热饱和溶液即可得到明矾晶体。


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
(1)操作A、B的名称分别是______、_____;加入稍过量的NH4HCO3溶液的作用是_______。
(2)写出在空气中充分加热煅烧FeCO3的化学方程式:__________。
II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
(3)写出滴定过程中发生反应的离子方程式:_________。
(4)确定滴定达到终点的操作及现象为_________。
(5)上述样品的质量分数为_________。
(6)下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有______。
a.未干澡锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.π键是由两个p电子“头碰头”重叠形成的
B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的键全为σ键,乙烯分子中含σ键和π键
D.H2分子中含σ键,Cl2分子中含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个反应中,过氧化氢所起的作用是
①H2O2+H2S=2H2O+S↓;②2H2O2=2H2O+O2↑;③H2O2+Cl2=2HCl+O2↑
A.起相同作用B.只起氧化剂作用
C.起不同作用D.只起还原剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列是某研究性学习小组对某无色水样成分的检测过程,已知该水样中只可能含有K+ 、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取了100ml水样进行实验:向水样中先滴加硝酸钡溶液,再滴加1mol·L-1硝酸,实验过程中沉淀质量与所加试剂量的关系变化如下图所示:

(1)仅凭观察可知该水样中一定不含有的阳离子是________。
(2)由B点到C点变化过程中消耗硝酸的体积为__________ml。
(3)试根据实验结果推测K+是否存在_______(填“是”或“否”)若存在,其物质的量浓度的范围是______mol·L-1(若不存在,则不必回答)。
(4)设计简单实验验证原水样中可能存在的离子__________________________________(写出实验步骤、现象和结论)。
II.湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
(1)写出并配平湿法制高铁酸钾反应的离子方程式:_________________________。
(2)若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________ mol。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),原因_______________________________________________________________________。
(4)已知K2FeO4能水解产生Fe(OH)3用作净水剂,请写出水解的离子方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为探讨苯和溴的反应改进的实验装置图.其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上.

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内发生反应,写出A中所发生的主要反应的化学方程式(有机物写结构简式)_________________________________________________________________________________。
(2)①反应开始后观察D试管,看到的现象为________________________________________________________,②观察E试管,看到的现象为___________________________________________________________________。说明苯和溴发生了③______________________反应(填反应类型)。
(3)B中的NaOH溶液作用是吸收反应生成的溴苯中溶解的溴单质,则A中铁粉的作用是①_______,试管C中苯的作用是②____________________________________________________。
(4)在上述整套装置中,具有防倒吸的仪器除D外还有_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表示中正确的是( )
A. 乙醇分子的球棍模型为 B. 一氯甲烷的电子式为
B. 一氯甲烷的电子式为
C. 乙酸的结构简式:C2H4O2D. 分子组成为C5H12的有机物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下n为气体。m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是

A. 原子半径:Z>Y
B. 化合物p中只存在离子键
C. 最简单气态氢化物的稳定性:W>X
D. 图示转化关系涉及的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
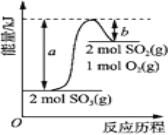
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com