
【题目】25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是( )
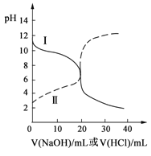
A.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
【答案】A
【解析】
曲线I开始时pH>7,滴定过程中pH减小,是用盐酸滴定氨水,曲线Ⅱ开始时pH<7,滴定过程中pH增大,是用氢氧化钠滴定醋酸。
A.曲线I中滴加溶液到20mL时,得到NH4Cl溶液,溶液中铵根离子水解,溶液呈酸性;
B.曲线Ⅰ是用盐酸滴定氨水;
C.曲线Ⅱ是用氢氧化钠滴定醋酸;
D.曲线Ⅱ中滴加溶液到10mL时,得到等浓度的CH3COOH、CH3COONa混合溶液,结合微粒守恒、电荷守恒判断。
曲线I开始时pH>7,滴定过程中pH减小,是用盐酸滴定氨水,曲线Ⅱ开始时pH<7,滴定过程中pH增大,是用氢氧化钠滴定醋酸。
A.曲线I中滴加溶液到20mL时,得到NH4Cl溶液,溶液中铵根离子水解,溶液呈酸性,则溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-),A正确;
B.曲线Ⅰ是用盐酸滴定氨水,B错误;
C.曲线Ⅱ是用氢氧化钠滴定醋酸,C错误;
D.曲线Ⅱ中滴加溶液到10mL时,得到等浓度的CH3COOH、CH3COONa混合溶液,根据物料守恒可得:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),联立可得:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),D错误;
故合理选项是A。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.某盐的水溶液呈酸性,该盐一定是强酸弱碱盐
B.中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量相同
C.水的离子积常数![]() 随着温度的升高而增大,说明水的电离过程是吸热的
随着温度的升高而增大,说明水的电离过程是吸热的
D.弱电解质溶液稀释后,溶液中各种离子浓度一定都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g![]() 的变化如右图所示。下列说法正确的是
的变化如右图所示。下列说法正确的是
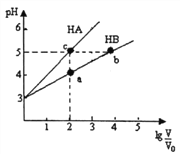
A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 强电解质溶液的导电能力一定比弱电解质溶液强
B. 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠物质的量等于醋酸所需氢氧化钠物质的量
C. 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的![]()
D. 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10-23:1
D.a点对应的Ksp大于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法错误的是( )
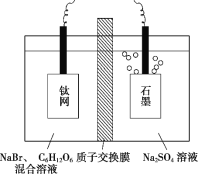
A.钛网与直流电源的正极相连,发生还原反应
B.石墨电极的反应为2H2O+2e-=H2↑+2OH-
C.电解过程中硫酸钠溶液浓度保持不变
D.生成葡萄糖酸的化学方程式为CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干电池的工作原理如图所示,总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
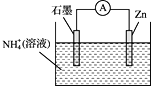
A.石墨为电池的负极B.电池工作时NH4+被氧化
C.实现了电能向化学能转化D.电子由Zn电极经外电路流向石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(![]() )、c(H+)均减小
)、c(H+)均减小
B.常温下,c(![]() )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3)
D.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a∶b=2∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com