
向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起( )。
A.溶液的pH增大 B.CH3COOH的电离程度增大
C.溶液的导电能力减小 D.溶液的c (OH – )减小
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如下,它属于( ) 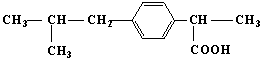
①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A.③⑤ B.②③ C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
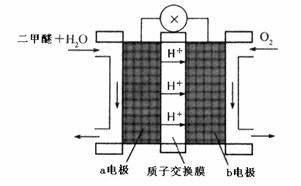
二甲醚(CH3OCH3)被称为21世纪界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
A.加入某物质作催化剂 B.加入一定量CO C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率
为 ;
若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H= 。
CH3OCH3(g)+CO2(g)的△H= 。
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如上图所示。b电极是 极,写出b电极上发生的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
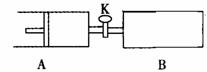 如图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY, 此时A的容积是a L,B的容积是2aL。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)
如图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY, 此时A的容积是a L,B的容积是2aL。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) 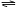 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法错误的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法错误的是( )
A.反应速率:v(B)>v(A) B.A 容器中X的转化率为80%
C.若打开K,则A的体积变为2.6a L D.平衡时Y的体积分数:A<B
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是( )。
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )。
A.若pH>7时,则一定是c1v1=c2v2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,若v1=v2,则一定是c2>c1
D.若v1=v2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量BaCO3 (Ksp = 8.1×10-9) 分别加入:①30mL 水; ②10mL 0.2mol/LNa2CO3溶液 ; ③50mL 0.01mol/L 氯化钡溶液; ④100mL 0.01mol/L盐酸中溶解至溶液饱和。
请确定各溶液中Ba2+的浓度由大到小的顺序为( )。
A.①②③④ B.③④①② C.④③①② D.②①④③
查看答案和解析>>
科目:高中化学 来源: 题型:
痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
①HUr(aq)  Ur- (aq)+H+(aq) (37℃时Ka=4.0×10-6)
Ur- (aq)+H+(aq) (37℃时Ka=4.0×10-6)
尿酸 尿酸根
②NaUr(s)  Ur- (aq)+Na+(aq)
Ur- (aq)+Na+(aq)
回答:
(1)37℃时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为_____。
(2)关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp____(填“增大”,“减小”或“不变”),生成尿酸钠晶体的反应是____(填“放热”或“吸热”)反应。
(3)37℃时,某尿酸结石病又尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/l,该病人尿液的c(H+)为__,pH__7(填“>”,“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
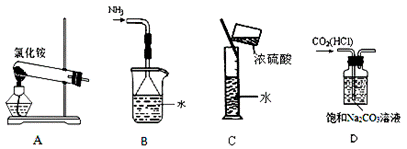
下列实验装置、选用的试剂或实验操作中,都正确的是( )
A.实验室用装置A制取氨气 B.用B装置吸收氨气,并防止倒吸
C.用C装置稀释浓硫酸 D.用D装置除去CO2中的HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com