
【题目】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐(已知:25℃,Ka(CH3COOH)=1.69×10-5)。
(1)醋酸钠溶液呈碱性的原因是_______________(写出有关的离子方程式)
(2)在CH3COONa溶液中离子浓度由大到小的顺序为_____________________(用c(Bn+)表示相应离子浓度);
(3)25℃时,0.10mol/L的醋酸溶液的pH约为___________(已知:lg1.3=0.114);
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解.
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是_______;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是____________;
A.0.02molL-1CH3COOH与0.02molL-1NaOH溶液等体积混合液
B.0.03molL-1CH3COOH与0.01molL-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液,则pH(CH3COONa)_______ pH(Na2CO3).(填:“>”、“<”或“=”)
【答案】 CH3COO+H2O CH3COOH+OH c(Na+)>c(CH3COO)>c(OH)>c(H+)或c(Na+)、c(CH3COO)、c(OH)、c(H+) 2.89或2.886 BC ABC C <
【解析】(1)醋酸钠是强碱弱酸盐,弱阴离子CH3COO-水解使溶液呈碱性,离子方程式为:CH3COO+H2O CH3COOH+OH。
(2)醋酸根离子水解,溶液显碱性,则c(Na+)>c(CH3COO)、c(OH)>c(H+),又因为一般水解是微弱的,所以c(Na+)和c(CH3COO)远大于c(OH)和c(H+),故CH3COONa溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO)>c(OH)>c(H+)或c(Na+)、c(CH3COO)、c(OH)、c(H+)。
(3)由已知,25℃时Ka(CH3COOH)=1.69×10-5,又因为Ka=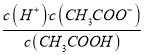 ,其中c(H+)=c(CH3COO-),c(CH3COOH)约为0.10mol/L,所以c(H+)=
,其中c(H+)=c(CH3COO-),c(CH3COOH)约为0.10mol/L,所以c(H+)=![]() =
=![]() =1.3×10-3mol/L,则pH=-lgc(H+)=3-lg1.3=2.886(或2.89)。
=1.3×10-3mol/L,则pH=-lgc(H+)=3-lg1.3=2.886(或2.89)。
(4)A项,稀释对电离和水解都有促进作用,则稀释时醋酸的电离程度增大,醋酸钠的水解程度增大,故A错误;B项,电离和水解均为吸热反应,所以升高温度,促进水解和电离,故B正确;C、D两项,醋酸电离是产生CH3COO,CH3COO水解是产生醋酸,二者作用相反,所以相互抑制,故C正确、D错误。
(5)因为25℃,Ka(CH3COOH)=1.69×10-5,所以Kh(CH3COO-)=![]() =
=![]() ,则Ka(CH3COOH)>Kh(CH3COO-),物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×(
,则Ka(CH3COOH)>Kh(CH3COO-),物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×(![]() ×0.1mol/L),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),综上分析A、B、C都正确。
×0.1mol/L),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),综上分析A、B、C都正确。
(6)A项,0.02molL-1CH3COOH与0.02molL-1NaOH溶液等体积混合,恰好生成醋酸钠,溶液显碱性;B项,0.03molL-1CH3COOH与0.01molL-1NaOH溶液等体积混合,得到醋酸和醋酸钠的混合溶液,剩余0.01mol/L醋酸;C项,pH=2的CH3COOH与pH=12的NaOH溶液等体积混合,得到醋酸和醋酸钠的混合溶液,
(7)弱酸酸性越强,对应的钠盐溶液中阴离子越容易水解,因为CH3COOH酸性强于HCO3-,所以0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液中,水解程度:CO32->CH3COO,弱阴离子水解溶液显碱性,水解程度越大碱性越强,pH越大,则pH(CH3COONa)<pH(Na2CO3)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )

A. M点溶液中水的电离程度比原溶液大
B. a=0.05
C. 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各个反应,不能用于工业生产的是
A. 二氧化锰和浓盐酸共热制氯气 B. 煅烧黄铁矿(FeS2)制SO2
C. 氯气与石灰乳反应制漂白粉 D. 电解熔融氯化镁制金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与装置有关的说法正确的是( )
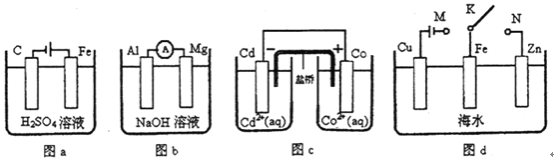
A. 图a中,随着电解的进行溶液中H+的浓度越来越大
B. 图b中,Mg电极作电池的负极
C. 图c中,发生的反应为Co+Cd2+= Cd+Co2+
D. 图d中:K分别与M、N连接,Fe电极均受到保护不会腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH相同的下列溶液中:①NH4Cl ②(NH4)2SO4 ③NH4HSO4,c(NH4+)相对大小为(用序号回答)_______________。
(2)25℃时,将amol/L的氨水与0.01mol/L的盐酸溶液等体积混合,所得溶液呈中性。用含a的代数式表示一水合氨的电离平衡常数Kb=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是:
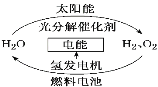
A. H2O的分解反应是放热反应
B. 氢能源已被普遍使用
C. 2 mol液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D. 氢氧燃料电池放电过程中是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A.H2SO4=2H++S6++4O2-B.NaHCO3=Na++H++CO32-
C.Ba(OH)2=Ba2++2OH-D.Na2CO3=Na2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com