
【题目】以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:

上述装置工作时,下列有关说法正确的是
A. Na+由乙池穿过交换膜进入甲池
B. 甲池电极反应:4CO32-+2H2O-4e-=4HCO3-+O2↑
C. 乙池电极接电池正极,气体X为H2
D. NaOH溶液Y比NaOH溶液Z浓度小
【答案】B
【解析】
由图可知甲池逸出氧气,甲池电极为阳极,阳极上水放电生成氧气和氢离子,氢离子与碳酸根反应生成碳酸氢根,乙池电极为阴极,阴极上水放电生成氢气和氢氧根,则气体X是氢气,Na+向阴极移动。
A项、Na+向阴极移动,由甲池穿过交换膜进入乙池,故A错误;
B项、甲池电极上水放电生成氧气和氢离子,氢离子与碳酸根反应生成碳酸氢根,电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑,故B正确;
C项、乙池电极为阴极,乙池电极接原电池负极,,阴极上水放电生成氢气和氢氧根,故C错误;
D项、电解时,甲池得到碳酸氢钠,乙池得到氢氧化钠,则NaOH溶液Y比NaOH溶液Z浓度大,故D错误。
故选B。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】在2L密闭容器,800℃时发生如下反应:
2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)写出该反应的平衡常数表达式 。
已知:K(400℃)>K(350℃),则该反应是 热反应。
(2)右图中表示Cu2O的物质的量随时间变化的曲线是 (选填“A”或“B”),800℃时,0~3min内该反应的平均速率v (CO2)= 。
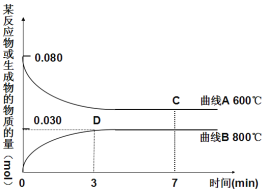
(3) 能说明该反应已达到平衡状态的是 。
a.v(CO)=v(CO2) b.容器内压强保持不变
c.v逆(CO)=v正(CO2) d.容器内气体的密度保持不变
(4)能使该反应的正反应速率增大,且平衡向正反应方向移动的是 。
A.增加CuO的量
B.适当升高温度
C.及时移去CO2
D.增大CO的浓度
E.选择高效催化剂
F.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:

完成下列填空
(1)氧原子最外层电子的轨道表示式为__________,该化学用语不能表达出氧原子最外层电子的______(填序号)。
a. 电子层 b. 电子亚层 c. 所有电子云的伸展方向 d.自旋状态
(2)四种元素中有两种元素处于同周期,下列叙述中不能说明这两种元素非金属性递变规律的事实是___________。
a.最高价氧化物对应水化物的酸性 b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价 d.气态氢化物的沸点
(3)由这四种元素中任意3种所形成的常见化合物中属于离子晶体的有_________(填化学式,写出一个即可),该化合物的水溶液显____(填“酸性”、“碱性”或“中性”)。
(4)写出该离子反应的方程式_______________,若将该反应设计成原电池,则N2应该在___________(填“正极”或“负极”)附近逸出。
(5)已知亚硝酸(HNO2)的酸性与醋酸相当,很不稳定,通常在室温下立即分解。则:
①酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I- 被氧化为I2时,产物中含氮的物质为______(填化学式)。
②要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是________(填序号)。
a. 稀硫酸 b. 二氧化碳 c. 二氧化硫 d. 磷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 L 1mol·L-1的NH4Fe(SO4)2溶液中,Fe3+数目与SO42-数目之比为1:2
B.标况下,22.4 L NO2与足量水反应生成0.5NA个NO分子
C.1 mol石墨和金刚石的混合物中,含碳碳键数目为4NA
D.K37ClO3+6H35Cl=3Cl2↑+KCl+3H2O若该反应转移5NA个电子,则生成212 g Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在史前就为人们所知,由于铁、钴、镍性质很相似故称为铁系元素。回答下列问题:
(1)铁、钴、镍中未成对电子数目最多的为_____,镍的外围电子轨道表达式为_____。
(2)Co2+可以和SCN-作用形成蓝色配离子,该反应可用于Co2+的定性检验。
①SCN-的空间构型为____,组成元素中第一电离能最大的是___。
②SCN-对应的酸有硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中后者沸点较高,主要原因是_________________。
(3)二茂铁是一种夹心式结构的配合物,通常认为是由一个Fe2+离子和两个C5H5-离子形成的,X射线研究结果指出两个C5H5-环的平面是平行的,结构如图1所示。C5H5-中碳原子的杂化类型为_____。分子中的大π键盘可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键盘电子数,则C5H5-中的大π键盘可以表示为______。
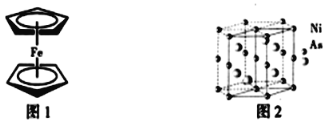
(4)NiAs晶体中的原子堆积方式如图2所示,其中As的配位数为______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,NiAs的密度为______g·cm-3,(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
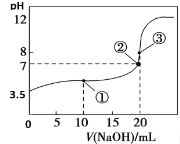
A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组制备SO2并探究SO2的相关性质,他们设计了如图装置(夹持仪器省略):

(1)实验需要大约100mL的1:1硫酸(浓硫酸与溶剂水的体积比),配制该硫酸时需要的玻璃仪器是:玻璃棒、______、_______,配制过程_______________________________。
(2)图中装置A的作用是________________________________。
(3)若需要对比干燥SO2和湿润的SO2的漂白性,则各仪器中需要加入的试剂分别是:
C:_____________D:_________ E:品红溶液 F:NaOH溶液
若需要先后验证SO2的氧化性与还原性,则各仪器中需要加入的试剂分别是:
C:空瓶 D:_____________ E:_________ F:NaOH溶液
写出验证SO2还原性装置中的离子反应方程式__________________________________。
(4)亚硫酸钠易被氧化,在下列方框内设计一个实验流程图测定亚硫酸钠的质量分数,设样品质量为W克,流程图样例如下,需要测定的数据自行设定符号表示,列出亚硫酸钠质量分数的计算表达式___________________,并说明各符号的意义:________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为
A.![]()
B.(a+3b)mol
C.![]()
D.(cV-3a-9b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
(1)用FeO作载氧剂,部分反应的lgKp与温度的关系如图所示。[已知:平衡常数Kp是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]

①图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
②R点对应温度下,向某恒容密闭容器中通入1.5 mol CO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________
CO2(g) +Fe(s),则CO的平衡转化率为______________
(2)在T℃下,向某恒容密闭容器中加入2 mol CH4(g)和8 mol FeO(s)进行反应:CH4(g)+4FeO(s) ![]() 4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为P0,达到平衡状态时,容器的气体压强是起始压强的2倍。
4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为P0,达到平衡状态时,容器的气体压强是起始压强的2倍。
①T℃下,该反应的Kp = ______________
②若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
③其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大” “减小”或“不变”)。
(3)一种微胶囊吸收剂,将煤燃烧排放的CO2以安全、高效的方式处理掉,胶囊内部充有Na2CO3溶液,其原理如图所示。
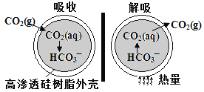
①这种微胶囊吸收CO2的原理是___________________(用离子方程式表示)。
②在吸收过程中当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)_____c(HCO3-)(填“>”、“ <”或“=”)
③将解吸后的CO2催化加氢可制取乙烯。
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H1= -1323kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2= -483.6kJ·mol-1
2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H3=_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com