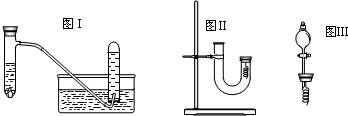
甲同学釆用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体
(1)写出试管内溶液中发生反应的化学方程式
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
(2)在实验过程中观察到试管内的溶液呈
绿
绿
色;收集气体的试管内的气体呈
无
无
色
(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
在铜和稀硝酸反应容器的上部看到了红棕色气体
有关化学方程式为:
2NO+O2=2NO2
2NO+O2=2NO2
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
| 实验步骤 |
问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 |
∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 |
现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 |
现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
(5)从环保的角度看,丙同学的实验存在的缺陷是
将氮氧化合物放入空气中会污染环境
将氮氧化合物放入空气中会污染环境
.
(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
3
3
步骤的相同.丁同学要将一氧化氮气体排入分液漏斗中应进行的正确操作是①
打开分液漏斗上部的塞子
打开分液漏斗上部的塞子
②
慢慢打开分液漏斗的活塞
慢慢打开分液漏斗的活塞
③
待液面与胶塞接触时立即关闭活塞
待液面与胶塞接触时立即关闭活塞
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
3NO2+H2O=2 HNO3+NO
3NO2+H2O=2 HNO3+NO
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO
2混合气体在标准状况下的体积为11.2L(不考虑NO
2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
10.86mol﹒L-1
10.86mol﹒L-1
②将产生的气体全部释放后,向溶液中加入VmL amol?L
-1的NaOH溶液,恰好使溶液中的Cu
2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
③已知NO和NO
2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
5.71
5.71
升.(保留两位小数);解题过程:
设生成的一氧化氮为xmol,二氧化氮为ymol.
3Cu+8HNO
3=3Cu(NO
3 )
2+2NO↑+4H
2O
3 2
1.5xmol xmol
Cu+4HNO
3(浓)=Cu(NO
3 )
2+2NO
2↑+2H
2O
1 2
ymol.ymol.
所以方程组为
所以
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H
2O+3O
2=4HNO
3
4 3
0.26mol 0.195mol
4 NO
2+2H
2O+O
2=4HNO
341
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
设生成的一氧化氮为xmol,二氧化氮为ymol.
3Cu+8HNO
3=3Cu(NO
3 )
2+2NO↑+4H
2O
3 2
1.5xmol xmol
Cu+4HNO
3(浓)=Cu(NO
3 )
2+2NO
2↑+2H
2O
1 2
ymol.ymol.
所以方程组为
所以
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H
2O+3O
2=4HNO
3
4 3
0.26mol 0.195mol
4 NO
2+2H
2O+O
2=4HNO
341
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
.