
【题目】下列说法正确的是
A. 将AlCl3溶液加热蒸干得到纯净的氯化铝晶体 B. 强电解质都易溶于水,所以BaSO4是弱电解质
C. 强酸溶液一定比弱酸溶液导电性强 D. 电解质溶液的导电过程会发生化学变化
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对平衡体系H2(g)+I2(g)![]() 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
B. 用稀盐酸洗涤AgCl沉淀比用等体积的蒸馏水洗涤损失的AgCl少
C. 实验室可用排饱和食盐水的方法收集氯气
D. 工业合成三氧化硫的过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按照单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
A.水银、干冰、硫酸、烧碱、纯碱
B.碘酒、冰、硝酸、苛性钠、胆矾
C.氢气、二氧化硫、盐酸、纯碱、硫酸铜
D.铜、氧化铜、醋酸、熟石灰、石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
(1)当空燃比(空气与燃油气的体积比)不同时,汽车尾气的主要成分不同。空燃比较小时的有毒气体主要是________(填化学式)。
(2)某分子筛类催化剂(H+交换沸石)催化NH3脱除NO、NO2的反应机理如图所示。

步骤③转化反应的离子方程式是________________。按上图反应机理,NH3脱除NO、NO2总反应的化学方程式是_____________________________。
(3)NaClO2溶液将NO转化为HNO3的反应历程如下:
NaClO2+HCl===HClO2+NaCl
8HClO2===6ClO2↑+Cl2↑+4H2O
2NaClO2+Cl2===2NaCl+2ClO2↑
5NO+3ClO2+4H2O===5HNO3+3HCl
则酸性条件下NaClO2溶液将NO转化为HNO3的总反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是________。
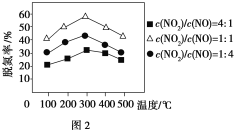
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

①由图1可知SCR技术中的氧化剂为________。
②用Fe作催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)=________。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO![]() ,SO
,SO![]() 可以被海水中的溶解氧氧化为SO
可以被海水中的溶解氧氧化为SO![]() 。海水的pH会________(填“升高”“不变”或“降低”)。
。海水的pH会________(填“升高”“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是_____________________。
(4)碲(Te)为第ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是___________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子在分子内吸引电子的能力大小可用一定数值 x 来表示,若 x 越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的 x 值:
元素符号 | Li | Be | B | C | N | F |
x 值 | 0.98 | 1.57 | 2.04 | 2.25 | 2.89 | 3.98 |
元素符号 | Na | Mg | Si | P | S | Cl |
x 值 | 0.93 | 1.35 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析 x 值变化规律,确定Al、N的 x 值范围:________< x (Al)<________
(2)推测 x 值与原子半径关系是________,根据短周期元素的 x 值变化特点,体现了元素性质的________变化规律。
(3)某有机化合物结构式为: ,其中SO键中你认为共用电子对偏向谁?________(写原子名称)。
,其中SO键中你认为共用电子对偏向谁?________(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是________。
(5)预测元素周期表中, x 值最小的元素的位置:_______(放射性元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯里一中2018届高一(1)班的两名同学用酸碱中和滴定的方法测定烧碱溶液的浓度。过程如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准硫酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且30秒内颜色不再改变为止,测得所耗硫酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗盐酸为V2mL。
试回答下列问题:
(1)滴定时边滴边摇动锥形瓶,眼睛应观察______________;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)锥形瓶中的溶液从_______色变为_______色时,且30秒种不变化,停止滴定。
(3)该小组在步骤中①错误是______________,由此造成的测定结果分别是_______,(填偏高、偏低或无影响)。
(4)步骤②缺少的操作是______________________。
(5)如下图,是某次滴定时的滴定管中的液面,则其读数为_______mL。

(6)根据下列数据

请计算待测烧碱溶液的浓度为______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A. △H4= 2/3(△H1+△H2- 3△H3) B. △H4= 2/3(3△H3-△H1-△H2)
C. △H4= 3/2(△H1+△H2- 3△H3) D. △H4= 3/2(△H1-△H2- 3△H3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com