
【题目】填写下列空白:
(1)某元素的气态氢化物的化学式XH4,则其最高价氧化物对应的水化物的化学式为_________。
(2)氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则氧元素的相对原子质量为_________________。
(3)物质的量相同的H2O和D2O与足量钠反应,放出的气体的质量之比为 ____________。
(4)X2﹣含中子N个,X的质量数为A,则1g X的氢化物中含质子的物质的量是 ______mol。
(5)铷和另一种碱金属形成的合金4.6g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:__________。
【答案】 H2XO3 16a%+17b%+18c% 1:2 ![]() Li
Li
【解析】(1)某元素的气态氢化物的化学式XH4,最低价是-4价,则其最高价是+4价,因此最高价氧化物对应的水化物的化学式为H2XO3。(2)氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则氧元素的相对原子质量为16a%+17b%+18c%。(3)物质的量相同的H2O和D2O与足量钠反应,放出的气体分别是H2和D2,则其质量之比为2:4=1:2。(4)X2﹣含中子N个,X的质量数为A,则X的质子数=A-N,X的氢化物是H2X,所以1g X的氢化物中含质子的物质的量是![]() =
=![]() mol。 (5)0.2g氢气的物质的量为:0.2g/2g/mol=0.1mol,则
mol。 (5)0.2g氢气的物质的量为:0.2g/2g/mol=0.1mol,则
2M+2H2O=2MOH+H2↑
2 1
0.2mol 0.1mol
则合金的平均摩尔质量为:M=4.6g÷0.2mol=23g/mol,铷的相对原子量取85.5,则铷的摩尔质量为85.5g/mol,则另一种碱金属的摩尔质量一定小于23g/mol,故另一碱金属是Li。


科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述是可逆反应A(g)+2B(g)![]() 2C(g)在定容密闭容器中达到平衡的标志的是:
2C(g)在定容密闭容器中达到平衡的标志的是:
①C的生成速率与C的分解速率相等;
②单位时间内消耗amol A,同时生成2amolC;
③A、B、C的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦A、B、C的分子数目比为1:3:2;
⑧混合气体的密度不再变化
A.②⑤ B.①③④⑤ C.②⑥⑦⑧ D.⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl)可用作有机化学的氯化剂,在药物和燃料的制取中也有重要作用。某化学学习小组拟用干燥的氯气和二氧化硫在活性碳催化下制取硫酰氯。SO2(g) +Cl2(g) = SO2Cl2(l) △H=-97.3KJ/mol。实验装置如图所示(部份夹持装置未画出)
已知:硫酰氯通常条件下为无色液体,熔点是-54.1℃,沸点是69.1℃。在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。回答下列问题:

(1)盛放活性炭的仪器名称是________,丙中冷凝水的入口是______(填“a”或“b”)。如何控制反应物比例相等:________________________________________________________。
(2)戊装置上方分液漏斗中最好选用下列_________________试剂(填选项)
a、蒸馏水 b、饱和食盐水 c、浓氢氧化钠溶液 d、6.0mol/L盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是_________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分离两种产物的方法是______(填选项)
SO2Cl2 + H2SO4,分离两种产物的方法是______(填选项)
a、重结晶 b、过滤 c、蒸馏 d、萃取
(5)长期储存的硫酰氯会发黄,可能的原因是_________________________________________(用必要的文字和相关方程式加以解释)
(6)若反应中消耗的氯气体积为896ml(换算为标准状况下),最后经过分离提纯得到4.05g 纯净的硫酰氯,则硫酰氯的产率为___________________。为提高本实验中硫酰氯的产率,在实验中需要注意的事项有___________(填序号)
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若丙装置发烫,可适当降温 ④加热丙装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是

A. CH2C12有两种同分异构体
B. 丙烯能使溴水褪色
C. 戊醇在一定条件下能与乙酸发生酯化反应
D. 苯与足量氢气在镍催化作用下会发生加成反应生成环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)B极上的电极反应式为 。
(2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲醇的质量为 克,若要使溶液复原,可向电解后的溶液中加入的物质有 。
(3)目前已开发出用电解法制取ClO2的新工艺。

①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的 极( 填A或B) ,写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解CO(NH2)2(尿素)的碱性溶液制氢气的装置如图所示(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。下列说法不正确的是
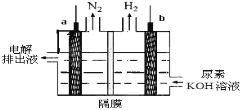
A.电解时,a极发生氧化反应
B.溶液中OH-逐渐向a极移动
C.电解时a极的电极反应式为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
D.若在a极产生标况下224mL N2,则消耗尿素2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池被广泛应用于电动汽车的动力来源,下列说法不正确的是( )
A. 负极通入甲醇
B. 正极通入氧气或空气
C. 无污染物质生成
D. 甲醇燃料电池的能量利用率比甲醇燃烧的能量利用率小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④ B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④ B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
A.只有④ B.②③ C.②③④ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com