
����Ŀ�������������
��1���ؿ��к�����һ����Ԫ�ع��ɵĵ���A�뻯����B��������Ϊ232�������û���Ӧ������Ϊ��ɫ����C����һ����D������D��ˮ�����ڸ����¿ɵõ�B����
��i��д�����ɽ�������A��Ԫ�������ڱ��е�λ��Ϊ ��
��ii��д��D��ˮ������Ӧ�Ļ�ѧ����ʽ ��
��2��ij��ú��ʯ��Ԥ������SiO2��63%����Al2O3��25%����Fe2O3��5%����������þ�Ļ�����ȣ�һ���ۺ����ù���������£� 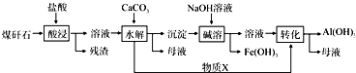
��i������X�Ļ�ѧʽΪ �� �����ܡ�ʱ��Ӧ�����ӷ���ʽΪ ��
��ii��Ϊ�ӿ조�����ʱ�����ʣ��ɲ�ȡ�Ĵ�ʩ�����ȣ��������ּ��ɣ�
��iii����֪Fe3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ2.1��3.2��Al3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ4.1��5.4��Ϊ�˻�ø����ƷAl��OH��3 �� ��ú��ʯ�������ȡҺ��ʼ����ֻ��CaCO3һ���Լ�������������ʵ�鷽���� ��
���𰸡�
��1���������ڢ�A�壻3Fe+4H2O ![]() Fe3O4+4H2
Fe3O4+4H2
��2��CO2��Al��OH��3+OH��=AlO2��+2H2O�����������Ũ�ȣ����߷�Ӧ�¶ȡ���Сú��ʯ������С����ֽ���ȣ�����CaCO3����pH��5.4�����˵õ�����
���������⣺��1���ؿ��к�����һ����Ԫ�ع��ɵĵ���A�뻯����B��������Ϊ232�������û���Ӧ������Ϊ��ɫ����C����һ����D������D��ˮ�����ڸ����¿ɵõ�B����AΪAl��BΪFe3O4 �� CΪFe��DΪAl2O3 �� ��i��AΪAl��A��Ԫ�������ڱ��е�λ��Ϊ�������ڢ�A�壬
���Դ��ǣ��������ڢ�A�壻 ��ii��DΪFe��D��ˮ������Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O ![]() Fe3O4+4H2 ��
Fe3O4+4H2 ��
���Դ��ǣ�3Fe+4H2O ![]() Fe3O4+4H2�� ��2����SiO2��63%����Al2O3��25%����Fe2O3��5%����������þ�Ļ�������������������ķ�ӦΪ��Al2O3+6H+�T2Al3++3H2O��Fe2O3+6H+�T2Fe3++3H2O������˵���ҺΪ�Ȼ������Ȼ�������Һ����̼���������Һ�е�������ʹ���������ӡ����������Ӷ�ˮ�������������������������ij����������ټ����������ƣ�ֻҪ���������ܽⷴӦΪ��Al��OH��3+OH���TAlO2��+2H2O��������ҺΪƫ��������Һ��ͨ�������̼��һ����Ӧ������������������i���Ȼ������Ȼ���ˮ�ⶼ�������ᣬ̼��ƺ����ᷴӦ�����Ȼ��ƺͶ�����̼����������X�Ƕ�����̼����������������������Һ��Ӧ���ɿ�����ƫ�����ƣ����ӷ�Ӧ����ʽΪ��Al��OH��3+OH��=AlO2��+2H2O��
Fe3O4+4H2�� ��2����SiO2��63%����Al2O3��25%����Fe2O3��5%����������þ�Ļ�������������������ķ�ӦΪ��Al2O3+6H+�T2Al3++3H2O��Fe2O3+6H+�T2Fe3++3H2O������˵���ҺΪ�Ȼ������Ȼ�������Һ����̼���������Һ�е�������ʹ���������ӡ����������Ӷ�ˮ�������������������������ij����������ټ����������ƣ�ֻҪ���������ܽⷴӦΪ��Al��OH��3+OH���TAlO2��+2H2O��������ҺΪƫ��������Һ��ͨ�������̼��һ����Ӧ������������������i���Ȼ������Ȼ���ˮ�ⶼ�������ᣬ̼��ƺ����ᷴӦ�����Ȼ��ƺͶ�����̼����������X�Ƕ�����̼����������������������Һ��Ӧ���ɿ�����ƫ�����ƣ����ӷ�Ӧ����ʽΪ��Al��OH��3+OH��=AlO2��+2H2O��
���Դ��ǣ�CO2��Al��OH��3+OH��=AlO2��+2H2O����ii������Ӱ�췴Ӧ���ʵ����ؿ�֪��Ϊ�ӿ조�����ʱ�����ʣ��ɲ�ȡ�Ĵ�ʩ�����������Ũ�ȡ����߷�Ӧ�¶ȡ���Сú��ʯ������С����ֽ���ȣ�
���Դ��ǣ����������Ũ�ȡ����߷�Ӧ�¶ȡ���Сú��ʯ������С����ֽ���ȣ���iii��Fe3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ2.1��3.2��Al3+��ʼ�����ͳ�����ȫ��pH�ֱ�Ϊ4.1��5.4��Ҫʹ��������ȫ�����������Ӳ�����������Һ��PHӦ��Ϊ3.2������������������ʱ������ҺpHΪ5.4����ʹ����������ȫ������
���Դ��ǣ�����CaCO3����pH��5.4�����˵õ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ���������ũҩ��ҩ����Ϻϳɵ���Ҫ�м��壬�����ɱ��Ӻ���ȩ����һ�������·�Ӧ�Ƶã� 
�����й�˵������ȷ���ǣ� ��
A.������Ӧ��ԭ�������ʿɴﵽ100%
B.�ں˴Ź��������ж��ǻ�������Ӧ����6�����շ�
C.���ǻ���������Է����ӳɷ�Ӧ��ȡ����Ӧ�����۷�Ӧ
D.1 mol���ǻ�������������NaOH��Һ��Ӧ������3 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�Ļ���ԭ�ϣ�ij̽��С���������з�Ӧ��ȡˮ���£�N2H4H2O����
CO��NH2��+2NaOH+NaClO�TNa2CO3+N2H4H2O+NaCl
��1��ʵ��һ���Ʊ�NaClO��Һ����ʵ��װ����ͼ1��ʾ��
������30%NaOH��Һʱ�����貣����������Ͳ�⣬���������ţ���
A������ƿ B���ձ� C����ƿ D��������
����ƿ�з�����Ӧ�Ļ�ѧ����ʽ�� ��
�������ʵ����Ҫ���������к͵ζ�ԭ���ⶨ��Ӧ����ƿ�л����Һ��NaOH��Ũ�ȣ���ѡ�����ṩ���Լ������ʵ�鷽�����ṩ���Լ���H2O2��Һ��FeCl2��Һ��0.1000molL��1���ᡢ��̪��Һ��
��2��ʵ�������ȡˮ���£���ʵ��װ����ͼ2��ʾ��
���Ʒ�Ӧ�¶ȣ�����Һ©������Һ��������������ƿ�У���ַ�Ӧ����������������ƿ�ڵ���Һ���ռ�108��114����֣�����֪��N2H4H2O+2NaClO�TN2��+3H2O+2NaCl����Һ©���е���Һ�������ţ���
A��CO��NH2��2��ҺB��NaOH��NaClO�����Һ
ѡ��������� ��
��3��ʵ�������ⶨ������º�����
��ȡ���5.000g����������NaHCO3���壬��ˮ���250mL��Һ���Ƴ�25.00mL����0.1000molL��1��I2��Һ�ζ����ζ������У���Һ��pH������6.5���ң�����֪��N2H4H2O+2I2�TN2��+4HI+H2O��
�ٵζ������У�NaHCO3�ܿ�����Һ��pH��6.5���ң�ԭ���� ��
��ʵ��������I2��Һ��ƽ��ֵΪ18.00mL�������ˮ���£�N2H4H2O������������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LED��Ʒ��ʹ��Ϊ��������ɫ�ʣ���ͼ������ȼ�ϵ������LED�����һ��װ��ʾ��ͼ�������й�������ȷ���ǣ� �� 
A.a��ͨ��O2
B.b��Ϊ��������������˻�ԭ��Ӧ
C.ͨ��O2�ĵ缫������Ӧ��O2+4e��+4H+=2H2O
D.��װ�ý���ѧ������ת��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100molL��1 NaOH��Һ�ֱ�ζ�20.00mL 0.100molL��1������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ���ǣ� �� 
A.���ʾ���ǵζ����������
B.pH=7ʱ���ζ��������ĵ�V��NaOH��С��20mL
C.V��NaOH��=20.00mLʱ��������Һ��c��Cl����=c��CH3COO����
D.V��NaOH��=10.00mLʱ��������Һ��c��Na+����c��CH3COO������c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH=2��A��B��������Һ��1mL���ֱ��ˮϡ�͵�1L����pH����Һ���V�Ĺ�ϵ��ͼ��ʾ��������˵����ȷ���ǣ� �� ��a=5ʱ��A��ǿ�ᣬB�����
����A��B�������ᣬ��5��a��2��
��ϡ�ͺ�A����Һ�����Ա�B����Һǿ��
��A��B��������Һ�����ʵ���Ũ��һ����ȣ�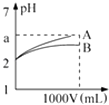
A.�٢�
B.�ۢ�
C.�٢�
D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��£�ˮ��Һ��H+��OH-��Ũ�ȱ仯������ͼ������˵����ȷ���ǣ� ��

A. �����¶ȣ�����������c��b�ı仯
B. ���¶��£�ˮ�����ӻ�����Ϊl.0��10-13
C. ���¶��£�����FeCl3����������b��a�ı仯
D. ���¶��£�ϡ����Һ����������c��d�ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�Ļ�ѧ����ʽ�����ӷ���ʽ�������ӷ�Ӧ�ģ�ֻд���ӷ���ʽ����
��1��ʵ������������ ��
��2����������ˮ�У� ��
��3����ʯӢɰ�ƴֹ裺 ��
��4�����Ȼ�����Һ����ӡˢ��·�壺 ��
��5����ƫ��������Һ��ͨ������Ķ�����̼�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ����ʽΪ �� ���÷�Ӧ6NO2+8NH3 ![]() 7N2+12H2OҲ���Դ���NO2 �� ��ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������ L��
7N2+12H2OҲ���Դ���NO2 �� ��ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������ L��
��2����֪��
2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1
2NO ��g��+O2��g��2NO2��g����H=��113.0kJmol��1
��ӦNO2��g��+SO2��g��SO3��g��+NO ��g�� �ġ�H=kJmol��1 �� һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1mol SO3��ͬʱ����1mol NO2
���������Ӧƽ��ʱ��NO2��SO2�����Ϊ1��6����ƽ�ⳣ��K= ��
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO ��g��+2H2��g��CH3OH ��g����
��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ1��ʾ���÷�Ӧ��H0���������������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������� ��
�ڼ״�ȼ�ϵ�أ����DMFC�����ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC����ԭ����ͼ2��ʾ��ͨ��a����ĵ缫��ԭ��ص��������������������缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com