
【题目】写出下列反应的化学方程式或离子方程式(是离子反应的,只写离子方程式).
(1)实验室制氯气: .
(2)氯气溶于水中: .
(3)用石英砂制粗硅: .
(4)用氯化铁溶液制作印刷电路板: .
(5)向偏铝酸钠溶液中通入过量的二氧化碳: .
【答案】
(1)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)Cl2+H2O?H++Cl﹣+HClO
(3)SiO2+2C ![]() Si+2CO↑
Si+2CO↑
(4)2Fe3++Cu=2Fe2++Cu2+
(5)AlO ![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO ![]()
【解析】解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰和氯气、水,离子方程式:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;所以答案是:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O;所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;(2)氯气与水反应生成氯化氢和次氯酸,离子方程式:Cl2+H2OH++Cl﹣+HClO;所以答案是:Cl2+H2OH++Cl﹣+HClO;(3)二氧化硅与碳反应生成硅和一氧化碳,化学方程式:SiO2+2C
Mn2++Cl2↑+2H2O;(2)氯气与水反应生成氯化氢和次氯酸,离子方程式:Cl2+H2OH++Cl﹣+HClO;所以答案是:Cl2+H2OH++Cl﹣+HClO;(3)二氧化硅与碳反应生成硅和一氧化碳,化学方程式:SiO2+2C ![]() Si+2CO↑;所以答案是:SiO2+2C
Si+2CO↑;所以答案是:SiO2+2C ![]() Si+2CO↑;(4)氯化铁与铜反应生成氯化亚铁和氯化铜,离子方程式:2Fe3++Cu=2Fe2++Cu2+;所以答案是:2Fe3++Cu=2Fe2++Cu2+;(5)二者反应生成氢氧化铝和碳酸氢钠,离子方程式:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO
Si+2CO↑;(4)氯化铁与铜反应生成氯化亚铁和氯化铜,离子方程式:2Fe3++Cu=2Fe2++Cu2+;所以答案是:2Fe3++Cu=2Fe2++Cu2+;(5)二者反应生成氢氧化铝和碳酸氢钠,离子方程式:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO ![]() ; 所以答案是:AlO
; 所以答案是:AlO ![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO ![]() .
.


科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)地壳中含量第一金属元素构成的单质A与化合物B(分子量为232)发生置换反应,产物为黑色固体C和另一单质D,单质D与水蒸气在高温下可得到B.则
(i)写出构成金属单质A的元素在周期表中的位置为 .
(ii)写出D与水蒸气反应的化学方程式 .
(2)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: 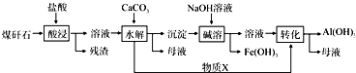
(i)物质X的化学式为 . “碱溶”时反应的离子方程式为 .
(ii)为加快“酸浸”时的速率,可采取的措施有、等.(填两种即可)
(iii)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4.为了获得更多产品Al(OH)3 , 从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL﹣1 . 下列说法正确的是( )
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8molL﹣1min﹣1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v= . 若上述反应在850℃下进行,反应2s时 n(NO)=0.009mol,并且不再随时间而改变,则该反应是热反应.
(2)图中表示NO2浓度变化的曲线是(填字母). 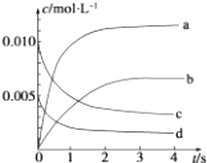
(3)能说明该反应已达到平衡状态的是(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量氯气通入KI溶液中,振荡,再加入CCl4,振荡,静置,观察到的现象是( )
A. 有紫黑色固体析出B. 形成均匀的紫红色溶液
C. 液体分层,下层紫红色D. 液体分层,上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为 5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式___________________________________。增加压强,NO的转化率______________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是________________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如图所示。由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_________(填“增大”、“不变”或“减小”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com