
| A、溶液中的各离子浓度一定存在下列关系:c(Na+)<2 c(CO32-)+c(HCO3-) |
| B、通入CO2,平衡向正反应方向移动 |
| C、稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
| D、加入NaOH固体,平衡向逆反应方向移动,溶液pH减小 |


科目:高中化学 来源: 题型:
 2Li0.85NiO2下列说法不正确的是( )
2Li0.85NiO2下列说法不正确的是( )| A、放电时,负极的电极反应式:Li-e-=Li+ |
| B、充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C、该电池不能用水溶液作为电解质 |
| D、放电过程中Li+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、A13+、HCO3-、SO42- |
| B、Na+、I-、SO32-、NO3- |
| C、NH4+、Fe2+、ClO-、C1- |
| D、K+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A=B |
| B、A=10-4 B |
| C、B=10-4 A |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
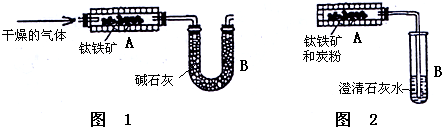
| 光合作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ② | |||
| ⑦ | ⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com