
 2Li0.85NiO2下列说法不正确的是( )
2Li0.85NiO2下列说法不正确的是( )| A、放电时,负极的电极反应式:Li-e-=Li+ |
| B、充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C、该电池不能用水溶液作为电解质 |
| D、放电过程中Li+向负极移动 |
 2Li0.85NiO2,可知,放电时,Li的化合价升高,被氧化,为原电池的负极,负极的电极反应式:Li-e-=Li+;充电时,反应逆向进行,反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应,也可根据Li0.85NiO2的Ni的氧化数由3.15升高到3.65,被氧化,部分Li+还原为Li,判断出充电时,Li0.85NiO2既发生氧化反应又发生还原反应;由于Li可以与水反应,故应为非水材料;原电池工作时,阳离子向正极移动,阴离子向负极移动.
2Li0.85NiO2,可知,放电时,Li的化合价升高,被氧化,为原电池的负极,负极的电极反应式:Li-e-=Li+;充电时,反应逆向进行,反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应,也可根据Li0.85NiO2的Ni的氧化数由3.15升高到3.65,被氧化,部分Li+还原为Li,判断出充电时,Li0.85NiO2既发生氧化反应又发生还原反应;由于Li可以与水反应,故应为非水材料;原电池工作时,阳离子向正极移动,阴离子向负极移动.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
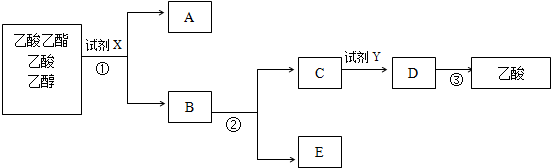
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、①③④ |
| C、①②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管 |
| B、碱式滴定管 |
| C、酸式、碱式滴定管都可以 |
| D、只能装入锥形瓶,不能装入滴定管中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中的各离子浓度一定存在下列关系:c(Na+)<2 c(CO32-)+c(HCO3-) |
| B、通入CO2,平衡向正反应方向移动 |
| C、稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
| D、加入NaOH固体,平衡向逆反应方向移动,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com