
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�顣
��.��1�����ơ��ء�þ������1 mol�ֱ�Ͷ�뵽������0.1 mol��L��1�������У���Ԥ��ʵ������ _______�����ᷴӦ��졣
��.������ͼװ�ÿ�����֤�ǽ����Եı仯���ɡ�

(2)����A������Ϊ________�������D��������____________________________��
(3)��Ҫ֤���ǽ����ԣ�S>C>Si����A�м� ____________��B�м�NaHCO3��Һ��C�м�___________���۲쵽C����Һ������Ϊ________________________________________________��
���𰸡� �� ��Һ©�� ��ֹ���� ϡ���� Na2SiO3��Һ ��Һ�����
����������1��ͬһ����Ԫ�أ�����������ԭ�����������������Ԫ�صĽ�����Խǿ��ͬһ���壬ԭ������Խ������Խǿ���䵥�������ˮ��ӦԽ���ң����Խ�����K��Na��Mg��Al����K�����ᷴӦ����ҡ�Al�����ᷴӦ������������2������AΪ��Һ©�������θ����D�ܹ���ֹ���������Ա���C��Һ�������ƿ�У���3����Ҫ֤���ǽ����ԣ�S��C��Si������ͨ����ǿ���Ʊ���������ʵ�֣���A�м���ϡ�����̼�����Ʒ�Ӧ����CO2��������̼�����Ʒ�Ӧ���������ԵĹ�����֤����C�з�ӦΪ��Na2SiO3+CO2+H2O=H2SiO3��+Na2CO3����˹۲쵽C����Һ������Ϊ��Һ����ǡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʼ��Ͻ������������е�Ӧ�������㷺��
��1�����̼�Ȼ�ԭ-�Ȼ�����ʵ�����������Ʊ�������������ط�Ӧ���Ȼ�ѧ����ʽ����Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) ��H = a kJ��mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) ��H = b kJ��mol-1
�ٷ�ӦAl2O3(s)+3C(s)=2Al(l)+3CO(g)�ġ�H=________kJ��mol-1(�ú�a��b�Ĵ���ʽ��ʾ)��
��Al4C3Ҳ�Ǹ÷�Ӧ�����е�һ���м���Al4C3 �����ᷴӦ(����֮һ�Ǻ�������ߵ���)�Ļ�ѧ����ʽΪ_______________��
�ۼ����ˮ��Ӧ������ˮú��(�������)���ں��¡��̶����ΪV�����ܱ������еķ�Ӧ��ʾ��ͼ������ʾ��������ʾ��ͼ�ó��Ľ����У���ȷ����_____________��


һ�������¾���t���Ӵﵽ��ѧƽ��
a. �÷�Ӧ����ʽΪ��CH4+H2O = CO+3H2
b. �÷�Ӧƽ��ǰ��ѹǿ��Ϊ3��4
c. �÷�Ӧ��ϵ�к���Ԫ�صĻ�������3��
d. �÷�Ӧ�м����ƽ��ת����Ϊ50%
��ˮú���е�H2����������NH3���ڽ���ϳ���ǰ����[Cu(NH3)2]Ac��Һ���������е�CO����ֹ�ϳ����еĴ����ж����䷴Ӧ�ǣ�
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)![]() [Cu(NH3)3]Ac��CO(aq) ��H��0
[Cu(NH3)3]Ac��CO(aq) ��H��0
[Cu(NH3)2]Ac��Һ����CO��������������Ӧ��____________________�����������������ʾ��ƽ�ⳣ������ʽΪ��K=______________
��2��þ���Ͻ�(Mg17Al12 )��һ��DZ�ڵ�������ϣ�һ������������н�һ����ѧ�����ȵ�Mg��Al ������һ���¶���������á��úϽ���һ�������¿���ȫ����õ��Ļ����Y(��MgH2 ��Al)��Y��һ�������¿��ͷų�������
�������Ʊ�þ���Ͻ�(Mg17Al12)ʱͨ�������Ŀ����_________________��
��д��þ���Ͻ�(Mg17Al12 ) ��һ����������ȫ����Ļ�ѧ����ʽ _________________��
����6. 0 mol��L-1 HCl ��Һ�У������Y ����ȫ�ͷų�H2��1 mol Mg17 Al12 ��ȫ�����õ��Ļ����Y ������������ȫ��Ӧ���ͷų�H2 �����ʵ���Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к��ذ�������һ�ֹ���Ⱦ�Ͼ���ѧ����������Ҫ��ɵĽṹ��ͼ��ʾ������˵������ȷ���ǣ� ��
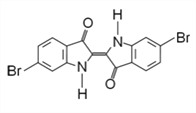
A. ��������������
B. ����ʽΪCl6H8O2N2Br2
C. lmol���л�����H2�ӳ��������9molH2
D. ���л�����Ԫ�ؼ���ɽ��л������Һ���Ⱥ�ֱ�Ӽ�����������Һ���۲��Ƿ���dz��ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ϵͳ�У���20. 00 mL 0.1000 mol��L-1�Ĵ�����Һ����μ���0.1000mol��L-1��NaOH��Һ����û����Һ���¶ȱ仯��ͼ���������˵����ȷ���ǣ� ��

A. ��a����Һ�����ԣ���ʱ��c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-)
B. ��a��b��![]() ������
������
C. ˮ�ĵ���̶ȣ�b�㣼c��
D. ��Һ��PHֵ��a�㣼c�㣼b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������,��Y��Zλ��ͬһ���ڡ�m��n��s������ЩԪ����ɵĶ�Ԫ�����p��q�ֱ���W��Z��Ԫ�ض�Ӧ�ĵ��ʣ�0.001 mol��L-1s��Һ��pHΪ3, t�ǻ����Һ���Ҹ���Һ����Ư���ԡ��������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����

A. Ԫ��Y�ֱ���W��X��Z�γɵĻ�������һ���������Ӽ�
B. ���Ӱ뾶��X��Y<Z
C. ��Ԫ��W��X��ɵĻ�������һ��ֻ�����Լ�
D. sΪǿ�ᣬrΪ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У�������Gָ�뷢��ƫת��ͬʱX���ų����壬Y����ϸ�������ж���ȷ����

A��X��Zn��Y��Cu��ZΪϡHCl��Һ
B��X��Cu��Y��Zn��ZΪϡH2SO4��Һ
C��X��Cu��Y��ʯī��ZΪϡAgNO3��Һ
D��X��ʯī��Y��Fe��ZΪϡAgNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������δ�����������Դ����ѧ��������Ƴ�����̫���ܲ������⣬ʹ��ˮ�ֽ�õ��������¼�����
2H2O![]() 2H2����O2�����Ƶõ�����������ȼ�ϵ�ء��Իش��������⣺
2H2����O2�����Ƶõ�����������ȼ�ϵ�ء��Իش��������⣺
(1)�ֽ⺣ˮʱ��ʵ���˴�________��ת��Ϊ________�ܡ����ɵ���������ȼ�ϵ��ʱ��ʵ��________��ת��Ϊ________�ܡ�ˮ�ֽ�ʱ�����ѵĻ�ѧ��Ϊ________�����ֽ⺣ˮ�ķ�Ӧ����_______��Ӧ(����ȡ������ȡ�)��
(2)ij������ȼ�ϵ�����ù�����������մ�������ʣ������Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��
A����2H2��2O2����4e��===2H2O��B����O2��4e��===2O2��
��A���ǵ�ص�________�������ӴӸü�________(����롱��������)��
(3)�����Ի�ѧ��Ӧ��2Zn��O2��4H��===2Zn2����2H2OΪ�������һ��ԭ��أ�������������Ϊ������������Դ�����ǿ�������ѪҺ������һ��Ũ�ȵ�O2��H����Zn2�����й�������ԭ��صĸ���������________�������ĵ缫��ӦΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϡ����±��ա����ƻ������������յ�������еĸ��ѻ����ϵ�ͻ�ơ��乤���������£�

���������ϡ�
�ٵ�������к���Cr(OH)3��Al203��ZnO��CuO��NiO�����ʣ�ˮ������Һ�к���Na2CrO4��NaAlO2��Na2ZnO2�����ʣ�
��Na2CrO4ת����Na2Cr2O7���ӷ�Ӧ����ʽΪ��2 CrO42-+2H+=Cr2O72-+H2O����Na2SO4��Na2Cr2O7��Na2CrO4�ڲ�ͬ�¶��µ��ܽ�����±���

��ش�
��1�������ٵ�������_______,��ˮ���������Һ��_______�ԣ�
��2��������������������Cr(OH)3ת����Na2CrO4�Ļ�ѧ����ʽΪ___________��
��3������II����Ҫ�ɷ���Zn(OH)2��X������X�����ӷ�Ӧ����ʽ__________��
��4�����ữŨ����ʱ�����������H2SO4��Ȼ��_______���ᾧ�����ˡ���������H2SO4Ŀ����__________��
��5���Ը�����Ϊԭ�ϣ��绯ѧ���Ʊ��ظ����Ƶ�ʵ��װ����ͼ��ʾ��

�����������ĵ缫��ӦʽΪ��_____________��
�����ⶨ����Һ��Na��Cr�����ʵ���֮��ֵΪd�����ʱ�����Ƶ�ת����Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����A��B��C��D�������ʻ�ͣ��������·�Ӧ��
aA��bB![]() cC(s)��dD
cC(s)��dD
����Ӧ����һ��ʱ����A������n mol��B������n /2mol��C������3n /2mol��D������n mol����ʱ�ﵽ��ѧƽ�⣺
(1) �û�ѧ����ʽ�и����ʵĻ�ѧ������Ϊ��
a�� ��b�� ��c�� ��d�� ��
��2�� ��ֻ�ı�ѹǿ����Ӧ�ٶȷ����仯����ƽ�ⲻ�����ƶ����÷�Ӧ�и����ʵľۼ�״̬��
A B D
��3����ֻ�����¶ȣ���Ӧһ��ʱ���֪�������������ʵ����ִﵽ�����÷�ӦΪ ��Ӧ(����ȡ������ȡ�)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com