
����Ŀ��C��N��S�������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ����IJ���Ӱ�졣
(1)��֪��2CO(g)��O2(g)=2CO2(g) ��H1=��566 kJ/mol
S(l)��O2(g)=SO2(g) ��H2=��296 kJ/mol
һ�������£�����ͨ��CO��SO2��Ӧ����S(1)��һ���������壬ʵ��ȼú��������Ļ��գ�д���÷�Ӧ���Ȼ�ѧ����ʽ_______________________________��
(2)��500���ºϳɼ״��ķ�Ӧԭ��Ϊ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��1 L ���ܱ������У�����1 mol CO2��3 mol H2��ѹǿΪp0 �����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ���,Ҳ������ƽ���ѹKp����ƽ��Ũ��,�����ѹ=��ѹ�����ʵ�������)
CH3OH(g)��H2O(g) ��1 L ���ܱ������У�����1 mol CO2��3 mol H2��ѹǿΪp0 �����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ���,Ҳ������ƽ���ѹKp����ƽ��Ũ��,�����ѹ=��ѹ�����ʵ�������)
�ٷ�Ӧ���е�4 min ʱ��v(��)____ (����>����<������=��)v(��)��0~4 min��H2��ƽ����Ӧ����v(H2)=____________mol��L��1��min��1��

��CO2ƽ��ʱ���������Ϊ_______________�����¶���KpΪ__________(�ú���p0��ʽ�ӱ�ʾ)��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����______________��
A��v��(CH3OH)=3v��(H2)
B��CO2��H2��CH3OH��H2OŨ��֮��Ϊ1: 3 :1: 1
C�����º�ѹ�£������������ٱ仯
D�����º����£�������ܶȲ��ٱ仯
��500�桢��2���ݻ�����2L���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | ������ | ������ |
��Ӧ����ʼͶ���� | 1 mol CO2��3 mol H2 | 0.5 mol CO2��1 mol H2 1 mol CH3OH��1 mol H2O |
CH3OH��ƽ��Ũ��/mol��L��1 | C1 | C2 |
���������з�Ӧ��ʼ��________������У�c1_________(����>����<������=��)c2��
���𰸡�2CO(g)��SO2(g)=S(l)��2CO2(g) ��H=��270 kJ/mol > 0.375 10% 256/3p02 C �淴Ӧ <
��������
(1) CO��SO2��Ӧ����S(1)���������������̼�����ݸ�˹����д�Ȼ�ѧ����ʽ��(2) �ٸ���ͼʾ����Ӧ���е�4 min ʱ���״������ʵ�����������˵����Ӧ������У�v(H2)=![]() �� �ڸ���ͼʾ��15min ʱ�ﵽƽ��״̬�����á�����ʽ������ƽ��ʱ�����ʵ���������ѹǿ�ȵ����������ʵ����ȼ���ƽ��ʱ����ѹǿ���۸���ƽ���־�������ܸ���Q��K�Ĺ�ϵ�����������ķ�Ӧ�����ݵ�Чƽ��ԭ�������������൱��Ͷ��Ϊ1.5 mol CO2��4 mol H2��
�� �ڸ���ͼʾ��15min ʱ�ﵽƽ��״̬�����á�����ʽ������ƽ��ʱ�����ʵ���������ѹǿ�ȵ����������ʵ����ȼ���ƽ��ʱ����ѹǿ���۸���ƽ���־�������ܸ���Q��K�Ĺ�ϵ�����������ķ�Ӧ�����ݵ�Чƽ��ԭ�������������൱��Ͷ��Ϊ1.5 mol CO2��4 mol H2��
(1)��2CO(g)��O2(g)=2CO2(g) ��H1=��566 kJ/mol����S(l)��O2(g)=SO2(g) ��H2=��296 kJ/mol�����ݸ�˹���ɢ�-�ڵ�2CO(g)��SO2(g)=S(l)��2CO2(g) ��H=��270 kJ/mol��(2) �ٸ���ͼʾ����Ӧ���е�4 min ʱ���״������ʵ�����������Ӧ������У�v(��) >v(��)��0~4 min��H2��Ũ�ȱ仯Ϊ1.5mol/L��v(H2)=![]() =
=![]() 0.375 mol��L��1��min��1���ڸ���ͼʾ��15min ʱ�ﵽƽ��״̬��CO��ƽ��Ũ��Ϊ0.25mol/L����
0.375 mol��L��1��min��1���ڸ���ͼʾ��15min ʱ�ﵽƽ��״̬��CO��ƽ��Ũ��Ϊ0.25mol/L����
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
��ʼ 1 3 0 0
ת�� 0.75 2.25 0.75 0.75
ƽ�� 0.25 0.75 0.75 0.75
CO2ƽ��ʱ���������Ϊ![]() 10%������ѹǿ�ȵ����������ʵ����ȣ�ƽ��ʱ����ѹǿΪ
10%������ѹǿ�ȵ����������ʵ����ȣ�ƽ��ʱ����ѹǿΪ![]() ��Kp=
��Kp= 256/3p02 �� ��A��ƽ��ʱ���淴Ӧ���ʱȵ���ϵ���ȣ�����v��(CH3OH)=3v��(H2)��ƽ�⣬�ʲ�ѡA��
256/3p02 �� ��A��ƽ��ʱ���淴Ӧ���ʱȵ���ϵ���ȣ�����v��(CH3OH)=3v��(H2)��ƽ�⣬�ʲ�ѡA��
B�� CO2��H2��CH3OH��H2OŨ��֮��Ϊ1: 3 :1: 1ʱ��Ũ�Ȳ�һ�����䣬����CO2��H2��CH3OH��H2OŨ��֮��Ϊ1: 3 :1: 1ʱ����һ��ƽ�⣬��ѡB��
C���÷�Ӧ��������DZ��������º�ѹ�£������������ٱ仯һ��ƽ�⣬��ѡC��
D���ں��º����£��÷�Ӧ���ܶ��Ǻ�����������ܶȲ��ٱ仯����һ��ƽ�⣬�ʲ�ѡD��
��500���ƽ�ⳣ��K=![]() ��Q=
��Q=![]() ��Q>K����Ӧ������У����ݵ�Чƽ��ԭ�������������൱��Ͷ��Ϊ1.5 mol CO2��4 mol H2���������ױ�������Ͷ�ϣ����Լ״���Ũ��c1<c2��
��Q>K����Ӧ������У����ݵ�Чƽ��ԭ�������������൱��Ͷ��Ϊ1.5 mol CO2��4 mol H2���������ױ�������Ͷ�ϣ����Լ״���Ũ��c1<c2��


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɳ��������һ�ֳ�Чƽ��ҩ����ϳɵIJ���·�����£�

(1)F�еĺ�������������Ϊ____________(д����)��
(2)C��D�ķ�Ӧ����Ϊ____________��
(3)B�ķ���ʽΪC8H8O3����(CH3)2C(OCH3)2����ȡ����Ӧ�õ�����C��CH3OH��д��B�Ľṹ��ʽ��________��
(4)д��ͬʱ��������������E��һ��ͬ���칹��Ľṹ��ʽ��__________��
�ٷ����к��б���������һ������̼ԭ�ӣ�������FeCl3������ɫ��Ӧ��
���ܷ���ˮ�ⷴӦ��ˮ�����֮һ�Ǧ������ᣬ��һ��������ˮ����������ֻ��3�ֲ�ͬ��ѧ�������⡣
(5)��д���� ��(CH3)2C(OCH3)2��CH3NO2Ϊԭ���Ʊ�
��(CH3)2C(OCH3)2��CH3NO2Ϊԭ���Ʊ� �ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������) _____��
�ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������) _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�����Ҫ�ɷ���������ͭ��Cu2O������ͭ�����Ҫ�ɷ�������ͭ��Cu2S��������ͭ�����ͭ���ϼ��������·�Ӧ��Cu2S+2Cu2O![]() 6Cu+SO2�������ж��ڸ÷�Ӧ��˵���У���ȷ���ǣ� ��
6Cu+SO2�������ж��ڸ÷�Ӧ��˵���У���ȷ���ǣ� ��
A.�÷�Ӧ�е�������ֻ��Cu2OB.Cu2S�ڷ�Ӧ�м������������ǻ�ԭ��
C.Cu���������������ǻ�ԭ����D.SO2���������������ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾA�ǹ���������ʣ�ȼ��ʱ����ʻ�ɫ��

(1)д������ת���Ļ�ѧ����ʽ��
A��B________________��
B��C___________��
(2)�о��������ʵ�һ����Ҫ��;��
A_____________��
B_________________��
(3)����������ת����ϵͼ�еĻ�ѧ��Ӧ�û��Ԫ�ػ��ϼ۱仯����______(����A��B����������ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�������Һ������Ũ�ȹ�ϵʽ��ȷ����
A. pH=5��H2S��Һ�У�c(H+)= c(HS��)=1��10��5mol��L��1
B. pH=a�İ�ˮ��Һ��ϡ��10������pH=b����a=b+1
C. pH=2��H2C2O4��Һ��pH=12��NaOH��Һ���������ϣ�c(Na��)+ c(H��)= c(OH��)+c( HC2O4��)
D. pH��ͬ����CH3COO Na��NaHCO3��NaClO������Һ��c(Na��)������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������[(NH4)2Fe(SO4)2]�Ƿ�����ѧ�е���Ҫ�Լ����ڲ�ͬ�¶��¼��ȷֽ���ﲻͬ�������ͼʵ��װ��(�г�װ����ȥ)����500��ʱ������������A�е�������������ֽ���ȫ��ȷ���ֽ����ijɷ�(C��D����Һ�ɷݾ�����)��

(1)Bװ�õ�������______________________________________��
(2)ʵ���У��۲쵽C������������D���а�ɫ�������ɣ���ȷ��������һ����__________���������д��D�з�����Ӧ�����ӷ���ʽ___________________________________����ȥ��C���Ƿ��ܵó�ͬ�����۲�������ԭ��__________________________��
(3)A�й�����ȫ�ֽ���Ϊ����ɫ��ĩ��ijͬѧ���ʵ����֤����������ΪFe2O3��������FeO������ɱ������ݡ�(�Լ�����������Ʒ��ѡ)
ʵ�鲽�� | Ԥ������ | ���� |
ȡ����A�в��������Թ��У���������ϡ���ᣬ�����ʹ����ȫ�ܽ⣬ƽ���ֳ�2�ݣ�_____ | _________________________ | ����������ΪFe2O3 |
(4)��E���ռ���������ֻ��N2�������ʵ���Ϊx mol�����������Fe2O3�����ʵ���Ϊy mol��D�г������ʵ���Ϊz mol������������ԭ��Ӧ�Ļ������ɣ�x��y��zӦ����Ĺ�ϵΪ___________��
(5)�������ʵ�������������ݵķ�����������������[(NH4)2Fe(SO4)2]��500��ʱ��������������ȫ�ֽ�Ļ�ѧ����ʽ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5���л���ѧ������������ӿ��������ƿ���ܰ���㾫������ɱ����ͷ��������ṹ��ʽ��ͼ��

��1��������ӷ���ʽΪ ��
��2������������һ���������ܸ�������ӷ�Ӧ���� ��
a��NaOH��Һ b��NaHCO3��Һ c��FeCl3��Һ d��Br2��CCl4��Һ
��3���������������Ķ�����ӵ�ͬ���칹�干��____________�֣�д������������һ�ֽṹ��ʽ___________��
�� ��NaHCO3��Һ��Ӧ
�� ������ֻ������ȡ����
�� �����ϵ�һ��ȡ����ֻ������
��4��������ӵ�ij��ͬ���칹��A�ɷ�������ת�������ַ�Ӧ��������ȥ����
��ʾ��RCH=CHR��![]() RCHO+R��CHO
RCHO+R��CHO

A��B�Ļ�ѧ����ʽΪ_______________________����Ӧ����Ϊ______________________��C�еμ�������ˮ����Ҫ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ء��������ǵ���A��Ԫ�أ������ڹ�ũҵ������Ӧ�÷dz��㷺��
��1����̬��ԭ�ӵĺ�������Ų�ͼΪ______________________��
��2��I1(Mg)___________I1(Al)(��������������С����)����ԭ����______________________��
��3�����Ȼ������ȵ�177.8��ʱ��������Ϊ��̬�����Ȼ���(Al2Cl6��������ԭ�Ӻ���ԭ�Ӿ���8�����ȶ��ṹ)����д�������Ȼ���(Al2Ci6)�Ľṹʽ��______________________��������ԭ�ӹ������___________�ӻ���
��4��BF4���Ŀռ乹��Ϊ___________,��BF4����Ϊ�ȵ�����ķ�����___________ (д��ѧʽ����дһ�ּ���)��
��5����(Ga)������(As)�γ��黯(GaAs)���壬�þ�����۵�Ϊ1238�����ܶ�Ϊ��g��cm��3���侧���ṹ��ͼ��ʾ���þ��������Ϊ________________��Ga��As��Ħ�������ֱ�ΪMGag��mol��1��MAsg��mol��1�������ӵ�����ֵΪNA������Ca��Asԭ�ӵĺ˼��Ϊ___________pm��(�г���ĸ����ʽ)
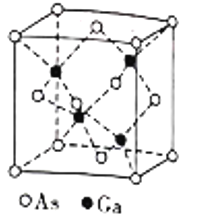
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com