

 CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1 CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。 CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。
| A.该流程至少包含4种形式的能量转化 |
| B.装置X中阴极反应为:2H2O-4e-=4H++O2↑ |
| C.合成塔中生成乙醇的反应是化合反应 |
| D.流程设计体现了绿色化学思想 |

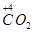 →
→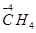 得8e-,生成8个单位的负电荷,结合电解液是氢氧化钾水溶液,负电荷的离子是OH-。
得8e-,生成8个单位的负电荷,结合电解液是氢氧化钾水溶液,负电荷的离子是OH-。

科目:高中化学 来源:不详 题型:单选题
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+41kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol O2(g)=Fe2O3(s) 的ΔH是( )
O2(g)=Fe2O3(s) 的ΔH是( )| A.-824.4 kJ/mol | B.-627.6 kJ/mol |
| C.-744.7 kJ/mol | D.-169.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g);ΔH=-90.8kJ·mol
CH3OH(g);ΔH=-90.8kJ·mol
 CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol
CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol
 CO2(g)+H2(g);ΔH=-41.3kJ·mol
CO2(g)+H2(g);ΔH=-41.3kJ·mol
 CH3OCH3(g)+CO2(g)的ΔH=__________
CH3OCH3(g)+CO2(g)的ΔH=__________ H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是。
2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是。
 CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。下列说法正确的是
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0

 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间/min浓度(mol/L) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0·30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.l7 |
 N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




 )。
)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com