
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0

 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 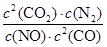 (2分) ②bd (2分)
(2分) ②bd (2分) 2CO2(g)+ N2(g)可知,该反应的平衡常数表达式K=
2CO2(g)+ N2(g)可知,该反应的平衡常数表达式K=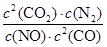 。
。 N2O4(g) △H=-56.9 kJ/mol、③H2O(g) = H2O(l) △H = -44.0 kJ/mol并依据盖斯定律可知,①-②+③×2即得到反应CH4(g)+N2O4(g)=N2(g) +2H2O(g) + CO2(l) ,所以该反应的反应热△H=-867 kJ/mol+56.9 kJ/mol-44.0 kJ/mol×2=—898.1kJ/mol。
N2O4(g) △H=-56.9 kJ/mol、③H2O(g) = H2O(l) △H = -44.0 kJ/mol并依据盖斯定律可知,①-②+③×2即得到反应CH4(g)+N2O4(g)=N2(g) +2H2O(g) + CO2(l) ,所以该反应的反应热△H=-867 kJ/mol+56.9 kJ/mol-44.0 kJ/mol×2=—898.1kJ/mol。

科目:高中化学 来源:不详 题型:单选题
 O2(g) = H2O(g) △H1
O2(g) = H2O(g) △H1 N2(g) + O2(g) = NO2 (g) △H2
N2(g) + O2(g) = NO2 (g) △H2 N2(g) +
N2(g) + 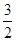 H2(g) = NH3 (g) △H3
H2(g) = NH3 (g) △H3 O2(g) =2NO2 (g) +3H2O(g) 的△H=
O2(g) =2NO2 (g) +3H2O(g) 的△H=| A.2△H1+2△H2—2△H3 | B.△H1+△H2—△H3 |
| C.3△H1+2△H2+2△H3 | D.3△H1+2△H2—2△H3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1 CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。 CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。
| A.该流程至少包含4种形式的能量转化 |
| B.装置X中阴极反应为:2H2O-4e-=4H++O2↑ |
| C.合成塔中生成乙醇的反应是化合反应 |
| D.流程设计体现了绿色化学思想 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.S(s,单斜)+O2(g)=SO2(g)△H ="+297.16" kJ?mol-1 |
| B.S(s,单斜)+O2(g)=SO2(g)△H ="-296.83" kJ?mol-1 |
| C.S(s,正交)+O2(g)=SO2(g)△H ="-296.83" kJ?mol-1 |
| D.单斜硫比正交硫更稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。 CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl; H2O(g) △H2,
H2O(g) △H2, CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。 4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ?mol-1; 5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ?mol-1; 7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ?mol-1; 2NO(g)的ΔH= kJ?mol-1。
2NO(g)的ΔH= kJ?mol-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com