
����Ŀ��2019��7��1�����Ϻ�������������ǿ��ʱ������������ȵ�Ҳ��ʼʵ���������ࡣ���������ҹ����������ľ��ģ������������뻯ѧϢϢ��أ������й�˵���������(![]() )
)
A.�ɻ��յ��������к�����������ͨ�����������������ȡ
B.���ޡ��顢˿��ë���ϳ���ά�ķϾ�����ȼ�մ���ʱ��ֻ����CO2��H2O
C.�����ľ���ϩ�������ڰ�ɫ����������ʹ��ˮ��ɫ
D.�Ͼɵ���к��������ӵ��ؽ�����������������
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NxOy��CO��SO2�ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
(1)��֪����NO2+CO![]() CO2+NO�÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)��ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����յ������ֱ�Ϊ
CO2+NO�÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)��ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����յ������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g)![]() 2NO(g) ��H=+179.5kJ/mol K2
2NO(g) ��H=+179.5kJ/mol K2
��2NO(g)+O2(g)![]() 2NO2(g) ��H=��112.3kJ/mol K3
2NO2(g) ��H=��112.3kJ/mol K3
д��NO��CO��Ӧ��������Ⱦ������Ȼ�ѧ����ʽ_____________________�����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=______________________(��K1��K2��K3��ʾ)
(2)ֱ���ŷź�SO2���������γ����꣬Σ������������NaOH���գ����ú������(H2SO3��HSO3-��SO32-)�����ڷ�Ӧ�����Һ�У����ǵ����ʵ�������X����ҺpH�Ĺ�ϵ��ͼ��ʾ��
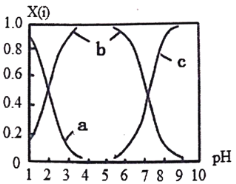
�ٲ����Һ��pH=8ʱ����Һ�и�����Ũ���ɴ�С��˳����___________��
���� NaHSO3��Һ�еμ�һ��Ũ�ȵ�CaCl2��Һ����Һ�г��ֻ��ǣ�pH���ͣ��û�ѧƽ���ƶ�ԭ��������ҺpH���͵�ԭ��________________________��
(3)��һ���¶��µĺ��������У���Ӧ2N2O(g)![]() 2N2(g)+O2(g)�IJ���ʵ���������£�
2N2(g)+O2(g)�IJ���ʵ���������£�
��Ӧʱ ��/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
����0~40minʱ�Σ���Ӧ����v(N2O)Ϊ___________mol/(L��min)��
����N2O��ʼŨ��c0Ϊ0.150 mol/L����Ӧ��30mnʱN2O��ת����a=___________��
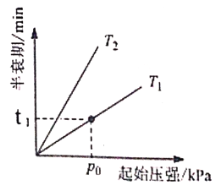
�۲�ͬ�¶�(T)�£�N2O�ֽ��˥������ʼѹǿ�ı仯��ϵ��ͼ��ʾ(ͼ�а�˥��ָ��һŨ��N2O����һ��ʱ�������Ӧʱ��)����T1___________T2(�>������=����<��)�����¶�ΪT1����ʼѹǿΪp0����Ӧ��t1minʱ����ϵѹǿp=___________(��p0��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2010�꣬�й��״�Ӧ����Ȳ������ͭƬ����ϳ���ʯīȲ��Ĥ(��ϳ�ʾ��ͼ����ͼ��ʾ)��������ĵ��ӽṹ�������㷺Ӧ���ڵ��Ӳ�����������˵������ȷ����( )
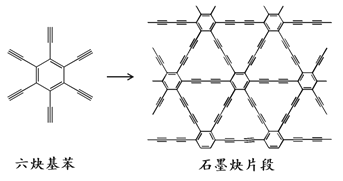
A.��Ȳ�����Ļ�ѧʽΪC18H6
B.��Ȳ������ʯīȲ������ƽ���ͽṹ
C.��Ȳ������ʯīȲ���ɷ����ӳɷ�Ӧ
D.��Ȳ�����ϳ�ʯīȲ���ڼӾ۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п��һ�ֶ���Ե����������ϣ�����������Ϳ�ϵȸ�������㷺��Ӧ�á���ҵ�ɴ�����п(������FeO��CuO ������) �Ʊ���������п�Ĺ�ҵ��������:

��֪:Fe3+��Fe2+��Cu2+��ȫ������pH�ֱ���:3.2��8.1��6.7
(1)�������ʱ�õ�������Һ���ܶ�Ϊ1��4g/mL����������Ϊ70%�������������ʵ���Ũ��Ϊ____��
(2)����ǰ�����Ŀ����____________________________________________��
(3)��Һ�м�п�۵�Ŀ����_____________________________________��
(4)����A����Ҫ�ɷ�_______________(�ѧʽ)������A�������ӵķ�����_______________��
(5)��Һ�м�H2O2������Ӧ�����ӷ���ʽ__________________________��
(6)6.82g��ʽ̼��п[aZn(OH)2��bZnCO3��cH2O]ǡ���ܽ���40mL3mol/LHCl�У�ͬʱ����448mLCO2(��״����)���������ʽ̼��п�Ļ�ѧʽΪ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������25��ʱ�������ܵ���ʵ��ܽ�ȣ�
���ܵ���� | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
�ܽ��/g | 9��10��4 | 1.7��10��6 | 1.5��10��4 | 3.0��10��9 |
������������ᴿ�У����������ܵ���ʵ��ܽ�ƽ��ԭ����ȥijЩ���ӣ��磺
��Ϊ�˳�ȥ�Ȼ���е�����Fe3�����Ƚ����������ˮ���ټ���һ�������Լ���Ӧ�����˽ᾧ���ɣ�
��Ϊ�˳�ȥ�Ȼ�þ�����е�����Fe3�����Ƚ����������ˮ������������������þ����ַ�Ӧ�����˽ᾧ���ɣ�
��Ϊ�˳�ȥ����ͭ�����е�����Fe2�����Ƚ����������ˮ������һ������H2O2����Fe2��������Fe3����������Һ��pH��4�����˽ᾧ���ɣ�
��ش��������⣺
��1�������������ӷ������ܹ��ﵽ�ܺõ�Ч����Fe2����Fe3������ת��Ϊ____________(�ѧʽ)����ȥ��
��2�����м�����Լ�Ӧ��ѡ��________Ϊ�ˣ���ԭ����__________��
��3�����г�ȥFe3�����������ܷ�Ӧ�����ӷ���ʽΪ______________________________��
��4�������뷽������ص������У���ȷ����______(����ĸ)��
A��H2O2����ɫ�������������������в��������ʣ���������Ⱦ
B����Fe2������ΪFe3������Ҫԭ����Fe(OH)2������Fe(OH)3�������ѹ���
C��������ҺpH��4��ѡ����Լ���������ͭ���ʽ̼��ͭ������ͭ
D��Cu2�����Դ���������pH��4����Һ��
E����pH��4����Һ��Fe3��һ�����ܴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���������������ȷ���ǣ� ��
A.��ܵĴ�С�Ի�ѧ��Ӧ�������仯������Ӱ��
B.��ѧ���Ķ��Ѻ��γ��ǻ�ѧ��Ӧ�з��������仯����Ҫԭ��
C.HCl(aq)��NaOH(aq)��Ӧ���к���Ϊ57.3kJ/mol����CH3COOH(aq)��NaOH(aq)��ȫ��Ӧ����1molH2O(l)ʱ���ų�������Ϊ57.3kJ
D.CO(g)��ȼ������283.0kJ/mol����Ӧ2CO2(g)=2CO(g)+O2(g)�ķ�Ӧ��![]() =+566.0kJ/mol
=+566.0kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����
A.�����ʵ������������������ֱ���ȫȼ�գ����߷ų�������
B.��C(ʯī��s)=C(���ʯ��s) ��H=+1.9kJ/mol��֪�����ʯ��ʯī�ȶ�
C.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l) ��H=��285.8kJ/mol
D.��ϡ��Һ�У�H+(aq)+OH��(aq)=H2O(l) ��H=��57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molKOH����Һ��ϣ��ų�����������57.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͪ�����һ�����õĿ�����ʹҩ������ͨ�����·����ϳɣ�
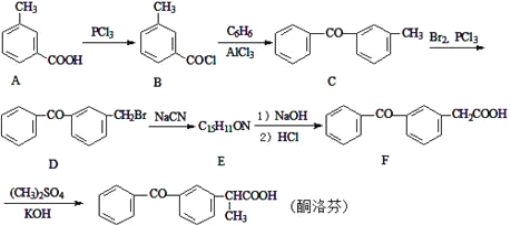
(1)������D�����������ŵ�����Ϊ_________________��
(2)������E�Ľṹ��ʽΪ___________________����B��C�ķ�Ӧ������_____________��
(3)д��C��D�ķ�Ӧ����ʽ____________________________��
(4)д��ͬʱ��������������A��һ��ͬ���칹��Ľṹ��ʽ____________________��
I.�ܷ���������Ӧ�� ��.��FeCl3������ɫ��Ӧ�� ��.�����к���5�ֲ�ͬ��ѧ��������.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϡ���ش��������⣺
(1)��ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦA��![]()
![]()
![]()
![]()
��ӦB��![]()
![]()
![]()
![]()
�ٶ��ڷ�ӦA��ƽ����������ݻ����䣬���д�ʩ������![]() ת���ʵ���_______��
ת���ʵ���_______��
A.�����¶� ![]() ����
����![]() ����
����
C.����He��ʹ��ϵ��ѹǿ���� ![]() ��ԭ�����ٳ���
��ԭ�����ٳ���![]() ��
��![]()
�ڶ��ڷ�ӦA�����������������䣬�����������������ִ�������Ӧ������ͬʱ���![]() ��ת�����淴Ӧ��ϵ���¶ȱ仯��ͼ��ʾ��
��ת�����淴Ӧ��ϵ���¶ȱ仯��ͼ��ʾ��

![]() ���з�Ӧһ������ƽ��״̬�ĵ���_________��������_____��
���з�Ӧһ������ƽ��״̬�ĵ���_________��������_____��![]() ��ת����a���c��ߵ�ԭ����_____��
��ת����a���c��ߵ�ԭ����_____��
��ij�¶��£���![]() ��
��![]() ������2L���ܱ������У���ַ�Ӧ���ﵽƽ����
������2L���ܱ������У���ַ�Ӧ���ﵽƽ����![]() ������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ_______________��
������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ_______________��
(2)��![]() �¶�ʱ����/span>
�¶�ʱ����/span>![]() ��
��![]() ����һ�����ܱ������У���ַ�Ӧ�ﵽƽ�����
����һ�����ܱ������У���ַ�Ӧ�ﵽƽ�����![]() ת����Ϊa���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ_________��
ת����Ϊa���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ_________��
(3)��ֱ���Լ״�Ϊȼ�ϵĵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ_____������״̬�£���ȼ�ϵ������![]() ���ܲ�����������Ϊ695kJ�����ȼ�ϵ�ص�����Ч��Ϊ____________
���ܲ�����������Ϊ695kJ�����ȼ�ϵ�ص�����Ч��Ϊ____________![]() ������λ��Ч����
������λ��Ч����![]() ��֪��
��֪��![]() ��ȼ����
��ȼ����![]() ��ȼ�ϵ�ص�����Ч����ָ�������������������ȼ�ϵ�ط�Ӧ�����ͷŵ�ȫ������֮��
��ȼ�ϵ�ص�����Ч����ָ�������������������ȼ�ϵ�ط�Ӧ�����ͷŵ�ȫ������֮��![]() ��
��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com