
����Ŀ������ȤζͼƬ��һ�����ᡱ�������������ظ�����������ļ���ʽ�ṹ�������й������������ȷ����

A. ����������к�������̼ԭ��
B. �����������ͬ���칹���У�����������-CH3���ṹ,�Һ����һ�֧���Ĺ���7��
C. �����ͬ���칹��(CH3)3CCH(CH3)CH2COOH������Ϊ2,2,3--��������
D. �����᳣���³�Һ̬����֬�᳣���³ʹ�̬���ʶ��߲�����ͬһͨʽ
���𰸡�B
��������A���������ĸ���ͬ���ŵ�̼ԭ�ӳ�Ϊ����̼ԭ�ӣ��ݴ��жϣ�
B���������ֱ��������˵�һ�����һ�֧����һ������֧��һ�����ݴ��жϣ�
C���������������������Ͻṹ��ʽ�жϣ�
D�������л���ķ���ʽ�жϡ�
A��������Ľṹ��ʽΪCH3(CH2)6COOH����˷����в���������̼ԭ�ӣ�A����
B���������ֱ��������˵�һ�����һ�֧����һ������֧��һ���������������������ͬ���칹���� ��
��![]() ��(CH3CH2)3CCOOH����3+3+1��7�֣�B��ȷ��
��(CH3CH2)3CCOOH����3+3+1��7�֣�B��ȷ��
C�����ݹ�����λ����С������̼ԭ�ӱ�ţ����Ը����ʵĽṹ��ʽ������Ϊ3��4��4���������ᣬC����
D�����ݶ��ߵķ���ʽ��֪���������֬�ᶼ�DZ���һԪ֬���ᣬ������ͨʽCnH2nO2����������������Cԭ�����٣������³�Һ̬������֬������Cԭ�����࣬�����³ʹ�̬��D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õ�ⷨ���ᴿ����ijЩ����������ʵĴ�����������Һ���乤��ԭ����ͼ��ʾ������˵���������

A. �������У���������Һ��pH����
B. �������У�K+ͨ�������ӽ���Ĥ������������������
C. �������У������ɷ�����Ӧ��4OH--4e-==2H2O+O2��
D. ������������Һ��b���ڵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ�У�Na+���ʵ���Ũ�������ǣ�������
A. 4 L��0.5 mol��L-1NaCl��Һ B. 1 L��0.3 mol��L-1Na2SO4��Һ
C. 5 L��0.4 mol��L-1NaOH��Һ D. 2 L��0.15 mol��L-1��Na3PO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������۾źš��롰�칬һ�š��ɹ��Խӣ����ҹ����˺�����ҵ��չ��������һ����־���ռ�ʵ���ҡ��칬һ�š��Ĺ���ϵͳΪ��������ȼ�ϵ��(RFC)��RFC��һ�ֽ�ˮ��⼼��������ȼ�ϵ�ؼ������ϵĿɳ���ء�����ͼΪRFC����ԭ��ʾ��ͼ�������й�˵����ȷ����(����)

A. ͼ�װѻ�ѧ��ת��Ϊ��أ�ͼ�Ұѵ���ת��Ϊ��ѧ�ܣ�ˮ�õ���ѭ��ʹ��
B. ����0.1 mol����ת��ʱ��a������0.56 L O2(��״����)
C. ͼ���е��Ӵ�c������d�����ṩ����
D. c���Ϸ����ĵ缫��Ӧ��O2��4H����4e��===2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ͼ���ʾ����ϸ����Ԫ�ء������a��b��c��d������ͬ��С�������ʣ�A��B��C������ͬ�Ĵ�������ʣ�������ش��������⣺
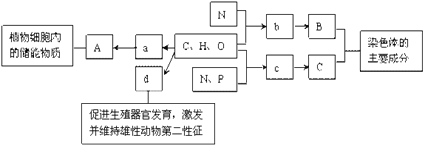
(1)�ڶ���ϸ���ڣ�������A�����������������_______��
(2)A��B��C������ϸ�����ںϳɵ���[ ]____��a��b��c��d������������[ ]____����ṹ��ʽ��____��
(3)����c������ϸ���й���____�֣������е�____��ͬ������c�����ͬ��
(4)ϸ���ڵ�B��C������ijЩ�Լ������ض�����ɫ��Ӧ������B��Ӧ������ɫ���ʵ��Լ���____��
(5)��B��C������ϸ��Ĥ�Ļ����ṹ,��C��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)̼�H2CO3��Ki1=4.3��10-7��Ki2=5.6��10-11
���H2C2O4��Ki1=5.9��10-2��Ki2=6.4��10-5
��0.1 mol/L Na2CO3��Һ��pH____________0.1 mol/L Na2C2O4��Һ��pH����ѡ����ڡ���С�ڡ����ڡ���
��������Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ�и�������Ũ�ȴ�С��˳����ȷ����_____����ѡ���ţ�
A��[H+]>[HC2O4-]>[HCO3-]>[CO32-] B��[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C��[H+]>[HC2O4-]>[C2O42-]>[CO32-] D��[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(2)�����������ɷ������·�Ӧ��P4+5O2= P4O10����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ�� P��P a kJ��mol-1��P��O b kJ��mol-1��P��O c kJ��mol-1��O��O d kJ��mol-1������ͼʾ�ķ��ӽṹ���й����ݹ���÷�Ӧ�Ħ�H=___________��

(3)25 �棬ijŨ�ȵ����ᡢ�Ȼ����Һ����ˮ�������������Ũ�ȷֱ�Ϊ1.0��10��amol��L��1��1.0��10��b mol��L��1����������Һ��pH֮��=___________��
(4)��t ��ʱ��ijBa(OH)2��ϡ��Һ��c(H��)��10��a mol/L��c(OH��)��10��b mol/L����֪a��b��12�������Һ����μ���pH��c�����ᣬ��û����Һ�IJ���pH���±���ʾ��
��� | ����������Һ �����/mL | ��������/mL | ��Һ��pH |
�� | 22.00 | 0.00 | 8 |
�� | 22.00 | 18.00 | 7 |
�� | 22.00 | 22.00 | 6 |
������Һ���ǰ�������仯���Բ��ƣ���c=___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϼ�G�����������кܶ���;,��ϳ�·������:

��֪:��R1��CHO+R2��CH2��CHO![]()
![]() (R1��R2������������ԭ��)
(R1��R2������������ԭ��)
��D��A��Ϊͬϵ��;����ͬ������,D����������������ܶ�Ϊ39��
(1)A��������____,G�к��������ŵ�������____��
(2)�ڵķ�Ӧ������____,B��F�Ľṹ��ʽ�ֱ�Ϊ______��______��
(3)д��һ���ܼ���A��D���Լ�:______;C�ж���ͬ���칹��,�������ڷ����廯�������____�֡�
(4)д����Ӧ�ٵĻ�ѧ����ʽ:_____________��
(5)G��ͬ���칹�� ��һ����Ҫ��ҩ���м���,��ϳ�·����G����,����
��һ����Ҫ��ҩ���м���,��ϳ�·����G����,����![]() Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_________��
Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ȼ������Ҫ�ɷ֣���һ����Ҫ�������Դ�ͻ���ԭ�ϡ�
(1)��ú����Ȼ��ʱ�ᷢ�������Ӧ��ͨ������;������CH4��
��֪��C(s)+2H2(g)![]() CH4 ��H=-73kJ/mol
CH4 ��H=-73kJ/mol
2CO(g)![]() C(s)+CO2(g) ��H=-171kJ/mol
C(s)+CO2(g) ��H=-171kJ/mol
CO(g)+3H(g)![]() CH4(g)+H2O(g) ��H=-203kJ/mol��
CH4(g)+H2O(g) ��H=-203kJ/mol��
д��CO��H2O(g)��Ӧ����H2��CO2���Ȼ�ѧ����ʽ_________________��
(2)��Ȼ���к���H2S���ʣ�ij����С���ð�ˮ���յõ�NH4HS��Һ����֪T��k(NH3��H2O)=1.74��10-5��k1(H2S)=1.07��10-7��k2(H2S)=1.74��10-13��NH4HS��Һ����������Ũ�ȴ�С��ϵ��ȷ����_______��
A.c(NH4+)>c(HS-)>c(OH-)>c(H+) B.c(HS-)>c(NH4+)>(S2-)>c(H+)
C.c(NH4+)>c(HS-)>c(H2S)>c(H+) D.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)��ҵ�ϳ���CH4��ˮ������һ������������ȡH2����ԭ��Ϊ��CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��һ���¶�ʱ����һ�����Ϊ2L�ĺ����ܱ������У�����lnmolCH4��1.4molˮ��������������Ӧ��5min���ƽ�⣬����0.2molCO����H2��ʾ�÷�Ӧ������Ϊ_________���˷�Ӧ��ƽ�ⳣ��Ϊ_____(���������С�������λ)��
������˵������˵���˷�Ӧ�ﵽƽ��״̬����_________��
A.��ϵ��ѹǿ���ٷ����仯
B.����1molCH4��ͬʱ����3molH2
C.����ֵ����ʵ���Ũ�Ȳ��ٸı�
D.��ϵ���ܶȲ��ٷ����仯
E.��Ӧ����V(CH4):V(H2O)v(CO):v(H2)=1:1:1:3
(4)�״�ˮ�����������ⷴӦ��CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ��H=+49kJ/mol��ij�¶��£���[n(H2O):n(CH3OH)]=1��1��ԭ������������ܱ������У���ʼѹǿΪp1����Ӧ�ﵽƽ��ʱ��ѹǿΪp2����ƽ��ʱ�״���ת����Ϊ______��
(5)��ͼ��ʾ��ֱ�Ӽ״�ȼ�ϵ�������ӽ���Ĥȼ�ϵ�ص�һ�ֱ��֣���ֱ��ʹ�ü״�������Ԥ����������д����ع���ʱ�ĸ�����Ӧʽ��__________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ksp[Mg(OH)2]=1.1��10-11�� Ksp(AgCl)=1.8��10-10��Ksp(Ag2CrO4)=1.9��10-12��������������ȷ������ ��
A. Ũ�Ⱦ�Ϊ2��10-5mol/L��AgNO3��Һ��NaCl��Һ�������ϣ��а�ɫ��������
B. ��0.001mol/L��AgNO3��Һ����Ũ�Ⱦ�Ϊ0.001mol/L��KCl��K2CrO4�����Һ�У��Ȳ���AgCl����
C. c(Mg2+)Ϊ0.11mol/L����Һ��Ҫ����Mg(OH)2��������Һ��pHҪ������9����
D. ������������ʱ����Ag2CrO4ˮ��Һ�м�������K2CrO4��������Һ��c(Ag+)����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com