
【题目】氮、碳氧化物的排放会对环境造成污染。多年来化学工作者对氮、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0;
N2O2(g) (快) H1<0;
v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0;
2NO2(g) (慢) H2< 0;
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①在两步的反应中,哪一步反应的活化能更大___(填“第一步”或“第二步”)。
②一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
II.(1)利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH1>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH3<0
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=______________________(用含 ΔH1 、ΔH2 、 ΔH3的代数式表示)若固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。


同温度下CO2的平衡转化率大于CH4的平衡转化率,原因是_________。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填 “大于”“小于”或“等于”)。已知气体分压(p 分)=气体总压(p 总)× 气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x 点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填 “大于”“小于”或“等于”)。已知气体分压(p 分)=气体总压(p 总)× 气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x 点对应温度下反应的平衡常数Kp=__________________。
III.根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的_________极,电解制备过程的总反应化学方程式为_________。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为_________。若选择用熔融K2CO3作介质的甲烷(CH4)燃料电池充当电源,则负极反应式为________________。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中左侧电极连接电源的_________极,电解制备过程的总反应化学方程式为_________。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为_________。若选择用熔融K2CO3作介质的甲烷(CH4)燃料电池充当电源,则负极反应式为________________。
【答案】第二步 ![]() ΔH1 +ΔH2 -ΔH3 CO2发生了其他副反应 大于
ΔH1 +ΔH2 -ΔH3 CO2发生了其他副反应 大于 ![]() 负 4Na2CrO4+4H2O
负 4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑ (2﹣
2Na2Cr2O7+4NaOH+2H2↑+O2↑ (2﹣![]() )×100% CH4﹣8e﹣+4CO32﹣=5CO2+2H2O
)×100% CH4﹣8e﹣+4CO32﹣=5CO2+2H2O
【解析】
Ⅰ. ①总反应的快慢由反应慢的一步决定,慢反应所需要的活化能更大,故答案为:第二步;
②因为反应达到平衡状态,所以v1正=v1逆,v2正=v2逆,所以v1正v2正=v1逆v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)k2正c(N2O2),则![]() ,故答案为:
,故答案为:![]() ;
;
Ⅱ.(1)将已知的三个反应重新组合,反应1+2-3,得到反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),根据盖斯定律得ΔH=ΔH1 + ΔH2 - ΔH3,反应方程式中CH4和CO2的化学计量数之比为1:1,投料比也为1:1,因此二者转化率应该相同,但是所给的转化率图像中,CO2转化率曲线高于CH4转化率曲线,可能是CO2发生了一些副反应造成的,故答案为:ΔH1 +ΔH2-ΔH3;CO2发生了其他副反应;
2CO(g)+2H2(g),根据盖斯定律得ΔH=ΔH1 + ΔH2 - ΔH3,反应方程式中CH4和CO2的化学计量数之比为1:1,投料比也为1:1,因此二者转化率应该相同,但是所给的转化率图像中,CO2转化率曲线高于CH4转化率曲线,可能是CO2发生了一些副反应造成的,故答案为:ΔH1 +ΔH2-ΔH3;CO2发生了其他副反应;
(2) 反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)是个气体体积增大的反应,压强越大,CH4的转化率越小,由图可知相同温度下,P1条件下的转化率大于P2,则P1小于P2,压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)>v(逆),由图可知该温度下X所处条件下的平衡时甲烷的转化率为50%,则有:
2CO(g)+2H2(g)是个气体体积增大的反应,压强越大,CH4的转化率越小,由图可知相同温度下,P1条件下的转化率大于P2,则P1小于P2,压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)>v(逆),由图可知该温度下X所处条件下的平衡时甲烷的转化率为50%,则有:
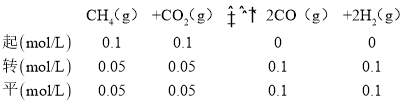
总物质的量=0.3mol,总压为P2,其平衡常数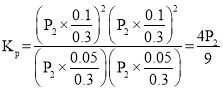 ,故答案为:大于;
,故答案为:大于;![]() ;
;
Ⅲ. 根据2CrO42-+2H+===Cr2O72-+H2O,电解Na2CrO4溶液制取Na2Cr2O7,应在酸性条件下进行,即右侧电极生成H+,则消耗OH-,发生氧化反应,右侧为阳极,则左侧为阴极,电解电源的负极,电解制备过程的总反应方程式为4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑,设加入反应容器内的Na2CrO4为1mol,反应过程中有x mol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x)mol,n(Cr)=(1-x)mol,生成的Na2Cr2O7为
2Na2Cr2O7+4NaOH+2H2↑+O2↑,设加入反应容器内的Na2CrO4为1mol,反应过程中有x mol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x)mol,n(Cr)=(1-x)mol,生成的Na2Cr2O7为![]() mol,对应的n(Na)=x mol,n(Cr)=x mol,根据Na与Cr的物质的量之比为a:b,解得x=
mol,对应的n(Na)=x mol,n(Cr)=x mol,根据Na与Cr的物质的量之比为a:b,解得x=![]() ,转化率为
,转化率为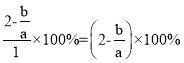 。
。
若选择用熔融K2CO3作介质的甲烷燃料电池充当电源,则负极反应式为CH4﹣8e﹣+4CO32﹣=5CO2+2H2O,故答案为;负;4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2﹣
2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2﹣![]() )×100%;CH4﹣8e﹣+4CO32﹣=5CO2+2H2O。
)×100%;CH4﹣8e﹣+4CO32﹣=5CO2+2H2O。


科目:高中化学 来源: 题型:
【题目】我国在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是(已知质子交换膜只允许H+通过)( )

A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是

A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在有机化学中广泛采用系统命名法,根据系统命名法原则,回答下列问题:
① 系统命名法命名下列物质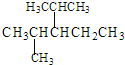 __________;
__________;
② 3,4-二甲基-2-戊烯的结构简式是_____________;
(2)![]() 中含有的官能团的名称为________。
中含有的官能团的名称为________。
(3)按要求书写下列化学方程式:
①甲苯制备TNT_____________;
②实验室制备乙炔______________。
(4)下列物质的沸点按由高到低的顺序排列正确的是_______。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A ④③②① B ②④③① C ②④①③ D ④②①③
(5)现有下列6种与人们生产生活相关的有机物:①CH3COOH(调味剂) ②HCOOCH3(烟草熏蒸剂)③![]() (制酚醛树脂)④
(制酚醛树脂)④ (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。 其中与①互为同分异构体的是________________(填序号)。
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。 其中与①互为同分异构体的是________________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用两种不饱和烃A和D为原料可以合成一类新药有机物J ,合成路线如下:

已知①
②有机物J结构中含两个环。
回答下列问题:
(1)C的名称是________________。
(2)A→B试剂和反应条件为________________。
(3)H→J的化学反应方程式为_______________。
(4)已知![]() 符合下列条件的 N的同分异构体有___________种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式____________。
符合下列条件的 N的同分异构体有___________种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式____________。
①含有基团![]() 、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是_____。
、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是_____。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(5)利用题中信息和所学知识,写出以A和甲烷为原料,合成![]() 的路线流程图____________(其它试剂自选)。
的路线流程图____________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是( )
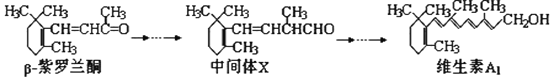
A. β—紫罗兰酮与中间体X互为同分异构体
B. β—紫罗兰酮不可使酸性KMnO4溶液褪色
C. 维生素A1易溶于NaOH溶液
D. 1mol维生素A1最多能与5molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 ( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 ( )
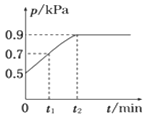
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=0.2/t1 mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com