
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=3v(N2) | C. | v(NH3)=1.5v(H2) | D. | v(N2)=2v(H2) |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池负极金属一定比正极金属的金属性活泼 | |
| B. | 原电池中电解质溶液中的阳离子向负极移动 | |
| C. | 碱性锌猛锰干电池的负极反应为:Zn-2e-+4OH-=ZnO22-+2H2O | |
| D. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
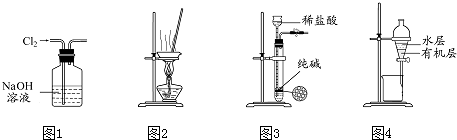
| A. | 用图1 所示装置除去Cl2中含有的少量HCl | |
| B. | 用图2 所示装置蒸干NH4HCO3饱和溶液制备NH4HCO3晶体 | |
| C. | 用图3 所示装置制取少量纯净的CO2气体 | |
| D. | 用图4 所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2能支持燃烧 | |
| B. | NO2不能支持燃烧 | |
| C. | 木条复燃是因为硝酸铜分解产生了氧气的缘故 | |
| D. | 木条复燃是因为硝酸铜分解产生了CuO催化作用的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3和NaHCO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 再通入$\frac{W}{10}$g氯化氢 | B. | B、蒸发浓缩成$\frac{W}{2}$g | ||
| C. | 蒸发掉溶剂的一半 | D. | 再加入2Wg25%盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y |
| Z |
| A. | Z、X、Y形成的气态氢化物稳定性依次增强 | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | 四种元素的原子半径:rZ>rY>rX>rW | |
| D. | 四种元素中,X的氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
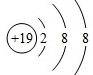 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com