
【题目】下列化学方程式书写正确的是( )
A.苯酚钠溶液中通入少量二氧化碳:2![]() + CO2 + H2O
+ CO2 + H2O ![]() 2
2![]() + Na2CO3
+ Na2CO3
B.乙酸乙酯的制备:CH3COOH + CH3CH218OH![]() CH3COOCH2CH3 + H218O
CH3COOCH2CH3 + H218O
C.用铁作电极电解饱和氯化钠溶液:2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D.1-丙醇与钠反应:2CH3CH2CH2OH + 2Na → 2CH3CH2CH2ONa + H2↑
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
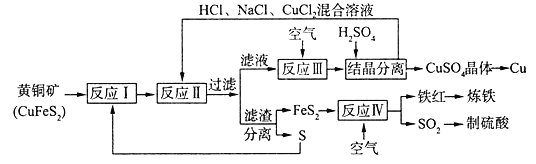
已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为__________________;
(2)“反应Ⅱ”的还原剂是_______________(填化学式);
(3)“反应III”的离子方程式为____________________________________;
(4)辉铜矿的主要成分是Cu2S,可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,有关转化如下如图 所示。转化时正极的电极反应式为___________________。
(5)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
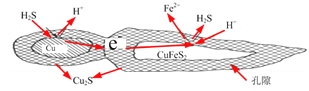
①反应Cu2S+4FeCl32CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化如图,其原因是_______________。

(6)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法正确的是__________。
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的![]() ,则N2的转化率为______________。
,则N2的转化率为______________。
(3)工业上合成氨的部分工艺流程如下:
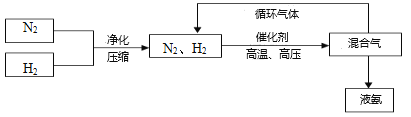
请用平衡移动原理来解释在流程中及时分离出氨气的原因_____________________________。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
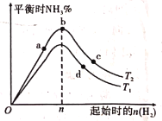
①图象中T2和T1的关系是:T2_______T1(填“>”“<”或“=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下该反应的化学平衡常数K=_______________。
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g) ![]() 2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1
N2(g)+O2(g) ![]() 2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-1
2H2(g)+O2 (g)![]() 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000mol·L-1和0.01000mol·L-1的标准盐酸。
②用0.1000mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00mL,结果用去盐酸19.60mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00mL,放入100mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00mL,用0.01000mol·L-1的盐酸滴定,用去盐酸34.80mL。请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?____;
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)滴定操作中,左手____,右手____,眼睛____;
(3)Ba(OH)2溶液的物质的量浓度是____;
(4)过滤所得浊液的目的是____;
(5)此空气样品中含CO2的体积分数为____;
(6)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果____(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:
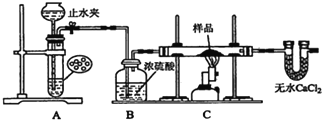
(1)仪器组装完成后,夹好止水夹,_____,则说明装置A的气密性良好.
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)
A.稀硫酸和锌片B.稀硝酸和铁片 C.氢氧化钠溶液和铝片D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号).
①打开止水夹②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________;丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学预设计实验证明另一种物质是否存在,其方案为__________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①I2(g)+H2(g)![]() 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g)![]() 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.I2(g)=I2(s) ΔH=-17.00 kJ/mol
C.固态碘的稳定性比气态碘的稳定性高
D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
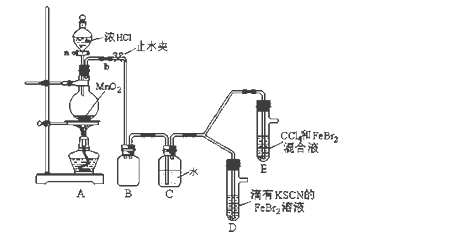
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池的结构如图所示。下列关于该电池的叙述不正确的是( )

A.该装置属于原电池
B.放电过程中,H+从负极区向正极区迁移
C.在电池反应中,每消耗1 mol氧气,理论上能生成11.2 L(标准状况)CO2
D.电池负极的电极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7溶液中存在下列平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
①H+ ②OH- ③K+ ④H2O
A.①③B.②④C.①④D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com