
ЁОЬтФПЁПProlitaneЪЧвЛжжПЙвжгєвЉЮяЃЌвдЗМЯуЬўAЮЊдСЯЕФКЯГЩТЗЯпШчЯТЃК
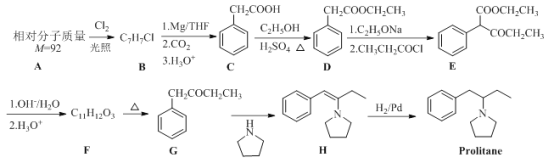
ЧыЛиД№вдЯТЮЪЬтЃК
(1)DЕФЛЏбЇУћГЦЮЊ______ЃЌHЁњProlitaneЕФЗДгІРраЭЮЊ______ЁЃ
(2)EЕФЙйФмЭХУћГЦЗжБ№ЮЊ______КЭ______ЁЃ
(3)BЕФНсЙЙМђЪНЮЊ______ЁЃ
(4)FЁњGЕФЛЏбЇЗНГЬЪНЮЊ______ЁЃ
(5)CЕФЭЌЗжвьЙЙЬхжаФмЭЌЪБТњзуЯТСаЬѕМўЕФЙВга______жж(ВЛКЌСЂЬхвьЙЙ)ЃЛ
ЂйЪєгкЗМЯуЛЏКЯЮя ЂкФмЗЂЩњвјОЕЗДгІ ЂлФмЗЂЩњЫЎНтЗДгІ
ЦфжаКЫДХЙВеёЧтЦзЯдЪОЮЊ4зщЗхЃЌЦфЗхУцЛ§БШЮЊ3ЁУ2ЁУ2ЁУ1ЃЌаДГіЗћКЯвЊЧѓЕФИУЭЌЗжвьЙЙЬхЕФНсЙЙМђЪН______ЁЃ
(6)ВЮееProlitaneЕФКЯГЩТЗЯпЃЌЩшМЦвЛЬѕгЩБНКЭввДМЮЊдСЯжЦБИБНМзЫсввѕЅЕФКЯГЩТЗЯп_____________(ЦфЫћЮоЛњЪдМСКЭШмМСШЮбЁ)ЁЃ
ЁОД№АИЁПБНввЫсввѕЅ МгГЩЗДгІЛђЛЙдЗДгІ єЪЛљ ѕЅЛљ ![]()
![]()
![]() + CO2Ёќ ЁОД№ЬтПе7ЁП4
+ CO2Ёќ ЁОД№ЬтПе7ЁП4 ![]()
ЁОНтЮіЁП
(1)ИљОнDЕФНсЙЙМђЪНПЩжЊDЕФУћГЦЮЊБНввЫсввѕЅЃЛH  гыЧтЦјдкДпЛЏМСДцдкЯТЗЂЩњМгГЩЗДгІВњЩњProlitane
гыЧтЦјдкДпЛЏМСДцдкЯТЗЂЩњМгГЩЗДгІВњЩњProlitane![]() ЃЌгыЧтЦјЕФМгГЩЗДгІвВНаЛЙдЗДгІЃЛ
ЃЌгыЧтЦјЕФМгГЩЗДгІвВНаЛЙдЗДгІЃЛ
(2)EНсЙЙМђЪНЮЊ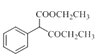 ЃЌИљОнНсЙЙМђЪНПЩжЊКЌгаЕФЙйФмЭХЗжБ№ЮЊѕЅЛљКЭєЪЛљЃЛ
ЃЌИљОнНсЙЙМђЪНПЩжЊКЌгаЕФЙйФмЭХЗжБ№ЮЊѕЅЛљКЭєЪЛљЃЛ
(3)AЯрЖдЗжзгжЪСПЪЧ92ЃЌПЩвдгыТШЦјдкЙтееЬѕМўЯТЗЂЩњШЁДњЗДгІВњЩњC7H7ClЃЌдђAЪЧМзБН![]() ЃЌBЪЧ
ЃЌBЪЧ![]() ЃЛ
ЃЛ
(4)E( 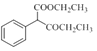 )дкМюадЬѕМўЯТЗЂЩњЫЎНтЗДгІЃЌШЛКѓЫсЛЏЕУЕНFЃК
)дкМюадЬѕМўЯТЗЂЩњЫЎНтЗДгІЃЌШЛКѓЫсЛЏЕУЕНFЃК ЃЌИУЮяжЪМгШШЗЂЩњЭбєШЗДгІВњЩњCO2КЭ
ЃЌИУЮяжЪМгШШЗЂЩњЭбєШЗДгІВњЩњCO2КЭ![]() ЃЌЗДгІЕФЗНГЬЪНЮЊЃК
ЃЌЗДгІЕФЗНГЬЪНЮЊЃК
![]()
![]() + CO2ЁќЃЛ
+ CO2ЁќЃЛ
(5)CНсЙЙМђЪНЮЊ![]() ЃЌЦфЭЌЗжвьЙЙЬхвЊЧѓЂйЪєгкЗМЯуЛЏКЯЮяЃЌЫЕУїКЌгаБНЛЗЃЛЂкФмЗЂЩњвјОЕЗДгІЃЌЫЕУїКЌгаШЉЛљЃЌЂлФмЗЂЩњЫЎНтЗДгІЃЌЫЕУїКЌгаѕЅЛљЃЌдђЦфЮЊМзЫсаЮГЩЕФѕЅЃЌПЩФмНсЙЙЮЊ
ЃЌЦфЭЌЗжвьЙЙЬхвЊЧѓЂйЪєгкЗМЯуЛЏКЯЮяЃЌЫЕУїКЌгаБНЛЗЃЛЂкФмЗЂЩњвјОЕЗДгІЃЌЫЕУїКЌгаШЉЛљЃЌЂлФмЗЂЩњЫЎНтЗДгІЃЌЫЕУїКЌгаѕЅЛљЃЌдђЦфЮЊМзЫсаЮГЩЕФѕЅЃЌПЩФмНсЙЙЮЊ![]() ЁЂ
ЁЂ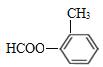 ЁЂ
ЁЂ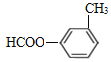 ЁЂ
ЁЂ![]() ЃЌЙВга4жжЃЛЦфжаКЫДХЙВеёЧтЦзЯдЪОЮЊ4зщЗхЃЌЦфЗхУцЛ§БШЮЊ3ЁУ2ЁУ2ЁУ1ЃЌЗћКЯвЊЧѓЕФИУЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЮЊ
ЃЌЙВга4жжЃЛЦфжаКЫДХЙВеёЧтЦзЯдЪОЮЊ4зщЗхЃЌЦфЗхУцЛ§БШЮЊ3ЁУ2ЁУ2ЁУ1ЃЌЗћКЯвЊЧѓЕФИУЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЮЊ![]() ЃЛ
ЃЛ
(6)гЩБНКЭввДМЮЊдСЯжЦБИБНМзЫсввѕЅЕФКЯГЩТЗЯпЪЧ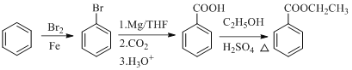 ЁЃ
ЁЃ


 гХЕШЩњЬтПтЯЕСаД№АИ
гХЕШЩњЬтПтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђ20 mL 0.40 mol/L H2O2ШмвКжаМгШыЩйСПKIШмвКЃКЂЁЃЎH2O2+I-=H2O+IOЉЃЛЂЂЃЎH2O2+IOЉ= H2O+O2Ёќ+ IЉЁЃH2O2ЗжНтЗДгІЙ§ГЬжаФмСПБфЛЏКЭВЛЭЌЪБПЬВтЕУЩњГЩO2ЕФЬхЛ§(вбелЫуБъзМзДПі)ШчЯТЁЃ
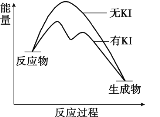
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
ЯТСаХаЖЯВЛе§ШЗЕФЪЧ
A. ДгЭМжаПЩвдПДГіЃЌKIФмдіДѓH2O2ЕФЗжНтЫйТЪ
B. ЗДгІЂЁЪЧЗХШШЗДгІЃЌЗДгІЂЂЪЧЮќШШЗДгІ
C. 0~10 minЕФЦНОљЗДгІЫйТЪЃКv(H2O2)Ёж9.0ЁС10-3 mol/(LЁЄmin)
D. H2O2дкЗДгІЙ§ГЬжаМШЬхЯжСЫбѕЛЏадЃЌгжЬхЯжСЫЛЙдад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉ25ЁцЪБЃЌpHЃН3ЕФбЮЫсжагЩЫЎЕчРыГіЕФc(HЃЋ)ЮЊ_______ЁЃ
ЃЈ2ЃЉ99ЁцЪБЃЌЯђpHЃН6ЕФеєСѓЫЎжаМгШыNaHSO4ОЇЬхЃЌБЃГжЮТЖШВЛБфЃЌВтЕУШмвКЕФpHЃН2ЁЃДЫЪБЫЎЕФРызгЛ§KwЃН_____ЃЌШмвКжаc(OH-)ЮЊ_____ЁЃ
ЃЈ3ЃЉ25ЁцЪБЃЌa molЁЄLЃ1CH3COOHШмвКЕФpHЃНbЃЌгУКЌaКЭbЕФДњЪ§ЪНБэЪОCH3COOHЕФЕчРыЦНКтГЃЪ§KaЃН________ЁЃ
ЃЈ4ЃЉ25ЁцЪБЃЌpHЃН3ЕФДзЫсКЭpHЃН11ЕФNaOHШмвКЕШЬхЛ§ЛьКЯКѓЃЌШмвКГЪ___(ЬюЁАЫсЁБЁЂЁАжаЁБЛђЁАМюЁБ)адЁЃ
ЃЈ5ЃЉ25ЁцЪБЃЌKa(CH3COOH)ЃН1.8ЁС10Ѓ5ЃЌKa(HSCN)ЃН0.13ЁЃИУЮТЖШЯТНЋ20mL 0.1molЁЄLЃ1CH3COOHШмвККЭ20mL 0.1molЁЄLЃ1HSCNШмвКЗжБ№гы20mL 0.1molЁЄLЃ1NaHCO3ШмвКЛьКЯЃЌЪЕбщВтЕУВњЩњЕФЦјЬхЬхЛ§(V)ЫцЪБМф(t)БфЛЏЕФЪОвтЭМШчЭМЫљЪОЃЌЗДгІГѕЪМНзЖЮЃЌСНжжШмвКВњЩњCO2ЦјЬхЕФЫйТЪДцдкУїЯдВювьЕФдвђЪЧ_____________________________________________ЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКpKaЃНЃlgKaЃЌ25 ЁцЪБЃЌH2SO3ЕФpKa1ЃН1.85ЃЌpKa2ЃН7.19ЁЃГЃЮТЯТЃЌгУ0.1 molЁЄL-1 NaOHШмвКЕЮЖЈ20 mL 0.1 molЁЄL-1 H2SO3ШмвКЕФЕЮЖЈЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
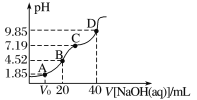
A.CЕуЫљЕУШмвКжаЃКc(Na+)ЃО3c(![]() )
)
B.DЕуЫљЕУШмвКжаЫЎНтЦНКтГЃЪ§Kh1ЃН10- 6.81
C.AЕуЫљЕУШмвКжаЃКV0ЕШгк10 mL
D.BЕуЫљЕУШмвКжаЃКc(Na+)ЃЋc(H+)ЃН2c(![]() )ЃЋc(
)ЃЋc(![]() )ЃЋc(OH-)
)ЃЋc(OH-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкШнЛ§вЛЖЈЕФУмБеШнЦїжаЃЌжУШывЛЖЈСПЕФвЛбѕЛЏЕЊКЭзуСПЬМЗЂЩњЛЏбЇЗДгІЃКC(s)+2NO(g)![]() CO2(g)+N2(g)ЃЌЦНКтЪБc(NO)гыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
CO2(g)+N2(g)ЃЌЦНКтЪБc(NO)гыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
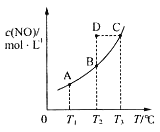
A.ИУЗДгІЕФІЄH>0
B.ШєИУЗДгІдкT1ЁЂT2ЁцЪБЕФЦНКтГЃЪ§ЗжБ№ЮЊK1ЁЂK2ЃЌдђK1<K2
C.дкT2ЁцЪБЃЌШєЗДгІЬхЯЕДІгкзДЬЌDЃЌдђДЫЪБvе§>vФц
D.ШєзДЬЌBЁЂCЁЂDЕФбЙЧПЗжБ№ЮЊp(B)ЁЂp(C)ЁЂp(D)ЃЌдђp(C)=p(D)>p(B)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)вбжЊГЃЮТЪБЃЌ0.1mol/LДзЫсдкЫЎжага0.1%ЗЂЩњЕчРыЃЌдђИУШмвКЕФpH=_____ЃЌДзЫсЕФЕчРыЦНКтГЃЪ§Ka=______ЁЃ
(2)ЯђБљДзЫсжаж№ЕЮМгЫЎЃЌШмвКЕМЕчадЫцМгШыЫЎЕФЬхЛ§БфЛЏШчЭМЫљЪОЃК
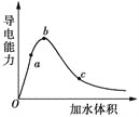
ЂйaЁЂbЁЂcШ§ЕуШмвКжаCH3COOHЕФЕчРыГЬЖШгЩДѓЕНаЁЕФЫГађЪЧ___ЁЃ
ЂкaЁЂcСНЕуЖдгІЕФШмвКЗжБ№ЮќЪеАБЦјЃЌШєСНШмвКзюжеpHОљЮЊ7ЃЈ25ЁцЪБЃЉЃЌдђaЕуШмвКжаЕФc(CH3COO-)_______cЕуШмвКжаЕФc(NH4+)ЁЃ(ЬюЁА<ЁБЁЂЁА>ЁБЛђЁА=ЁБ)
(3)25ЁцЪБЃЌВПЗжЮяжЪЕФЕчРыЦНКтГЃЪ§ШчБэЫљЪОЃК
ЛЏбЇЪН | CH3COOH | NH3ЁЄH2O | H2CO3 | HCN |
ЕчРыЦНКтГЃЪ§ | 1.7ЁС10-5 | 1.7ЁС10-5 | K1=4.3ЁС10-7 K2=5.6ЁС10-11 | K=5.0ЁС10-10 |
ЧыЛиД№ЯТСаЮЪЬтЃК
ЂйH2CO3ЕФЕкЖўМЖЕчРыЦНКтГЃЪ§ЕФБэДяЪНKa2=_______ЁЃ
Ђк25ЁцЪБЃЌЯђ0.1molL-1ЕФАБЫЎжаЛКЛКЭЈШыCO2ЦјЬхЕФЙ§ГЬжа(КіТдШмвКЬхЛ§ЕФБфЛЏ)ЃЌЯТСаБэДяЪНЕФЪ§жЕБфаЁЕФЪЧ___ЁЃ
AЃЎ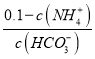 BЃЎ
BЃЎ![]() CЃЎ
CЃЎ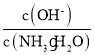 DЃЎ
DЃЎ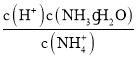
ЂлЯђNaCNШмвКжаЭЈШыЩйСПCO2ЦјЬхЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЪЧвЛИіЪЕбщЪвжЦШЁТШЦјВЂвдТШЦјЮЊдСЯНјааЬиЖЈЗДгІЕФзАжУЃЈBжагаЕМЙмКЭвЛИіСЌЭЈЭтНчЕФГЄОБТЉЖЗЃЉЃК

ЃЈ1ЃЉAЪЧТШЦјЗЂЩњзАжУЃЌЦфжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________________________ЃЎ
ЃЈ2ЃЉЪЕбщПЊЪМЪБЃЌЯШЕуШМAДІЕФОЦОЋЕЦЃЌДђПЊа§ШћKЃЌШУCl2ГфТњећИізАжУЃЌдйЕуШМDДІОЦОЋЕЦЃЌCl2ЭЈЙ§CЦПКѓдйНјШыDЁЃDзАжУЕФгВжЪВЃСЇЙмФкЪЂгаЬПЗлЃЌЗЂЩњбѕЛЏЛЙдЗДгІЃЌЦфВњЮяЮЊCO2КЭHClЁЃЪдаДГіDжаЗДгІЕФЛЏбЇЗНГЬЪНЃК___________________ЃЛзАжУCЕФзїгУЪЧ_________________ ЁЃ
ЃЈ3ЃЉдкEДІЃЌзЯЩЋЪЏШяЪдвКЕФбеЩЋгЩзЯЩЋБфЮЊКьЩЋЃЌдйБфЮЊЮоЩЋЃЌЦфдвђЪЧ__ЁЃ
ЃЈ4ЃЉШєНЋEДІЩеБжаШмвКИФЮЊГЮЧхЪЏЛвЫЎЃЌЗДгІЙ§ГЬжаЯжЯѓЮЊ___ЁЃЃЈбЁЬюБъКХЃЉ
ЃЈAЃЉгаАзЩЋГСЕэЩњГЩЃЈBЃЉЮоУїЯдБфЛЏЃЈCЃЉЯШЩњГЩАзЩЋГСЕэЃЌЖјКѓАзЩЋГСЕэЯћЪЇ
ЃЈ5ЃЉDДІЗДгІЭъБЯКѓЃЌЙиБеа§ШћKЃЌвЦШЅОЦОЋЕЦЃЌЕЋгЩгкгрШШЕФзїгУЃЌAДІШдгаCl2ВњЩњЃЌДЫЪБBжаЕФЯжЯѓЪЧ__ЃЌBЕФзїгУЪЧ___________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋвЛЖЈСПЕФNa2CO3КЭNaHCO3ЕФЛьКЯЮяМгШШЃЌГфЗжЗДгІжСЙЬЬхжЪСПВЛдйМѕЩйЃЌЩњГЩCO2ЦјЬхЕФЬхЛ§ЮЊ2.24LЃЌЗДгІКѓЕФЙЬЬхВадќгы100mLHClШмвКЧЁКУЭъШЋЗДгІЃЌгжЩњГЩCO2ЦјЬх4.48LЃЈЦјЬхЬхЛ§ОљдкБъзМзДПіЯТВтЖЈЃЉЁЃЪдЧѓЃК
ЃЈ1ЃЉдЛьКЯЮяжаNa2CO3КЭNaHCO3ЕФЮяжЪЕФСПИїЮЊЖрЩй_________ЃП
ЃЈ2ЃЉЫљгУHClШмвКЕФЮяжЪЕФСПХЈЖШ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋ11.5gФЦЁЂ9gТСЁЂ28gЬњЗжБ№ЭЖШы200![]() 1
1![]() ЕФбЮЫсжаЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
ЕФбЮЫсжаЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
A.ФЦгыбЮЫсЗДгІзюОчСвЃЌВњЩњЕФЦјЬхзюЖр
B.ТСгыбЮЫсЗДгІЕФЫйТЪНіДЮгкФЦЃЌЕЋВњЩњЕФЦјЬхзюЖр
C.ЬњгыбЮЫсЗДгІВњЩњЕФЦјЬхБШФЦЖр
D.ЗДгІНсЪјЪБВњЩњЕФЦјЬхвЛбљЖр
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com