
下列离子方程式正确的是( )
A.少量金属钠加到冷水中:Na+2H2O===Na++2OH-+H2↑
B.NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO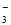 ===CaCO3↓+H2O
===CaCO3↓+H2O
C.硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO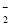 +4NH
+4NH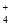 +2H2O
+2H2O
D.将2 mol/L AlCl3溶液和7 mol/L NaOH溶液等体积混合:2Al3++7OH-===Al(OH)3↓+ AlO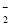 +2H2O
+2H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:选择题
化学与科技、社会、生产、生活密切相关。下列有关说法不正确的是
A.物质燃烧时产生有色火焰的都是焰色反应的见证
B.棉花、木材和植物秸秆的主要成分都是纤维素
C.航天服主要成分由碳化硅陶瓷和碳纤维复合而成,是一种复合材料
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO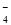 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:填空题
(10分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1 mol。
阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化。
(1)溶液中______(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是________________。
(2)原溶液中所含的阴离子为__________,阳离子为__________。
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为__________________。
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为__________g。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
在200 mL某硫酸盐溶液中含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数),同时含有NA个金属阳离子,则该硫酸盐的物质的量浓度为( )
A.1 mol/L B.2 mol/L C.2.5 mol/L D.5 mol/L
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列叙述正确的是( )
A.煤的干馏和石油的分馏均属化学变化
B.BaSO4在医学上用做钡餐,Ba2+对人体无毒
C.14C可用于文物的年代鉴定,14C与12C互为同素异形体
D.葡萄糖注射液不能产生丁达尔现象,不属于胶体
查看答案和解析>>
科目:高中化学 来源:2015届江西省第一学期高三第一次月考化学(A卷)试卷(解析版) 题型:填空题
铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是 。
(2)硫酸铁可作絮凝剂,常用于净水,其原理是 (用离子方程式表示)。在使用时发现硫酸铁不能将酸性废水中的悬浮物沉降除去,其原因是 。
(3)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4十4CO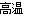 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市高三8月月考化学试卷(解析版) 题型:填空题
(8分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
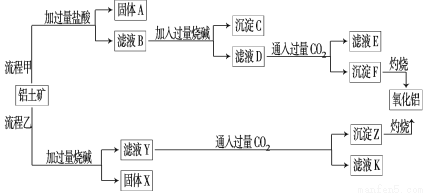
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_______________________________。
(2)流程乙加入烧碱后生成SiO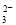 的离子方程式为___________________________。
的离子方程式为___________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入__________________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是_____(填化学式),写出该溶质的一种用途________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com