
| A、电解过程中阴极没有气体生成 |
| B、电解过程中转移的电子的物质的量为0.4 mol |
| C、原CuSO4溶液的浓度为0.1 mol?L-1 |
| D、电解过程中阳极收集到的气体体积为1.12 L(标况下) |
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
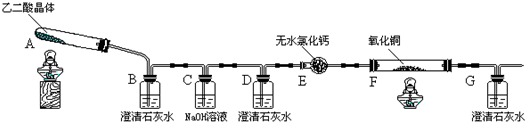
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 | |
| 滴定管 液面刻度 | 0.00mL | 20.02mL | 21.00mL | 19.98mL | 20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
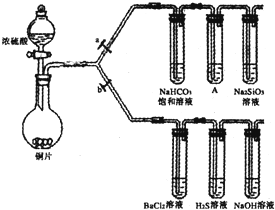
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定没有乙烯 |
| B、一定有乙烯 |
| C、一定没有甲烷 |
| D、一定有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
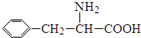 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示: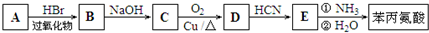
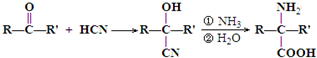
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1 mol/LHF溶液中pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、该体系中HF与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
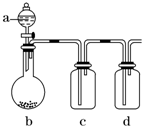
| A、若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色 |
| B、若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色 |
| C、若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 |
| D、若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡浓度A/B=5:3 |
| B、x=2 |
| C、B的平衡浓度为1.5mol?L-1 |
| D、A的转化率为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若体系恒容,通入H2S(g),则正反应速率增大,逆反应速率减小 |
| B、升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C、增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D、若体系恒容,注入一些H2后达新平衡,H2浓度将减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com