
����Ŀ��Ϊ�ⶨ̼��ƵĴ��ȣ��躬����SiO2����ij��ȤС���ͬѧ��������¼���ʵ�鷽����������
�ٳ�ȡ̼�����ƷM g
����c1mol/L������V1 mL���������ܽ���Ʒ
��ȡ�ܽ�����Һ�����ʮ��֮һ����c2 mol/L��NaOH��Һ�ζ���ǡ��ȥV2 mL��
������
�ٳ�ȡ̼�����ƷM g
�ڸ�������ֱ���������ٸı䣬��ȴ�������ʣ���������ΪM1g
������
�ٳ�ȡ̼�����ƷM g
�ڼ�������c mol/L������V mLʹ֮��ȫ�ܽ�
�۹��˲�ȡ��Һ
������Һ�м������c1 mol/L��Na2CO3��ҺV1 mL
�ݽ�������еij����˳���ϴ�ӡ�������أ�����ΪM1g��
��������ʵ�鷽�����ش��������⣺
��1���������м���̼��ƴ��ȵĹ�ʽΪ ��
��2���������еġ���ȴ��Ӧ��β������������� ��
��3���������в���Ҫ�������� ����ѡ���ţ���
A.c��V
B.c1��V1
C.M1
D.M
��4����������Ϊ�˼���ʵ������Ҫ�IJ����� ����ѡ���ţ���
A.��ȷ�ⶨNa2CO3��Һ�����V1 mL
B.��ȷ����Na2CO3��Һ��ʹ��Ũ��Ϊc1 mol/L
C.����������ó���ϴ�ӣ�ϴ��Һ�������
��5���������һ��ʵ�鷽����
���𰸡�
��1��![]() ��100%
��100%
��2��Ӧ���ڸ���������ȴ����ֹ���ɵ�CaO������е�CO2��H2O��Ӧ��������
��3��AB
��4��C
��5����ȡCaCO3��ƷMg��������������ᣬ�ռ����ⶨ��״�������ɵ���������VmL
���������⣺��1��̼��������ᷴӦ��ʣ�������ʮ��֮һ������������Һ�кͣ�����̼��Ʒ�Ӧ������ΪC1V1��10��3��10C2V2��10��3 �� ��̼������ʵ���Ϊ0.5��C1V1��10��3��10C2V2��10��3��������̼��ƴ���Ϊ ![]() ��100%���ʴ�Ϊ��
��100%���ʴ�Ϊ�� ![]() ��100%����2����CaO��������е�CO2��H2O������Ӧ�����Է��ڸ���������ȴ����ֹ���ɵ�CaO������е�CO2��H2O��Ӧ��������ʴ�Ϊ��Ӧ���ڸ���������ȴ����ֹ���ɵ�CaO������е�CO2��H2O��Ӧ���������3������������ᣬ̼���ȫ���ܽ�Ϊ�Ȼ�����Һ���������̼���ƻ����������Ϊ̼��Ƴ������������ϴ�Ӹ���õ��ij���������Ϊ��Ʒ��̼�������������õ�������������Ҫ�����dz�ȡ̼�����Ʒ M g�������裨4���еij����˳���ϴ�ӡ��������ΪM��g������Ҫ��������Ũ�Ⱥ�������ʴ�Ϊ��AB����4��Ϊ����ʵ������Ҫ�IJ����ǣ���С�����Ҫ�������ܽ��ĸ�����ȫ��ת�ƺ��������A����ȷ�ⶨNa2CO3��Һ���V��mL�����õ��dz���������̼������Һ����������������ȫ���ɣ���A�����ϣ�B����ȷ����Ũ��c��mol/L Na2CO3��Һ�����õ��dz���������̼������Һ����������������ȫ���ɣ���̼����Ũ�Ⱦ�ȷ���أ���B�����ϣ�C������������ó���ϴ�ӣ�ϴ��ҺҲӦ������У���֤�ܽ�ĸ���������ȫ��������������C���ϣ��ʴ�Ϊ��C����5������һ�������Ĺ����м�����������ַ�Ӧ��ⶨ���ɶ�����̼�����ڱ�״���µ��������������̼Ԫ���غ����̼��ƵĴ��ȣ����巽��Ϊ����ȡCaCO3��ƷM g��������������ᣬ�ռ����ⶨ��״�������ɵ���������VmL���ʴ�Ϊ����ȡCaCO3��ƷM g��������������ᣬ�ռ����ⶨ��״�������ɵ���������VmL�� ��1��̼��������ᷴӦ��ʣ�������ʮ��֮һ������������Һ�кͣ�����̼��Ʒ�Ӧ������ΪC1V1��10��3��10C2V2��10��3 �� ��̼������ʵ���Ϊ0.5��C1V1��10��3��10C2V2��10��3�����ݴ˼���̼��ƴ��ȣ���2����CaO�������������Ӧ�����Է��ڸ���������ȴ����ֹ���ɵ�CaO������е�CO2��H2O��Ӧ���������3�������������ù�����������������̼��ƵĴ��ȣ��ݴ˷����жϣ���4����С�����Ҫ�������ܽ��ĸ�����ȫ��ת�ƺ����������5��ʵ����ƿ�������һ�������Ĺ����м�����������ַ�Ӧ��ⶨ���ɶ�����̼�����ڱ�״���µ��������������̼Ԫ���غ����̼��ƵĴ��ȣ�
��100%����2����CaO��������е�CO2��H2O������Ӧ�����Է��ڸ���������ȴ����ֹ���ɵ�CaO������е�CO2��H2O��Ӧ��������ʴ�Ϊ��Ӧ���ڸ���������ȴ����ֹ���ɵ�CaO������е�CO2��H2O��Ӧ���������3������������ᣬ̼���ȫ���ܽ�Ϊ�Ȼ�����Һ���������̼���ƻ����������Ϊ̼��Ƴ������������ϴ�Ӹ���õ��ij���������Ϊ��Ʒ��̼�������������õ�������������Ҫ�����dz�ȡ̼�����Ʒ M g�������裨4���еij����˳���ϴ�ӡ��������ΪM��g������Ҫ��������Ũ�Ⱥ�������ʴ�Ϊ��AB����4��Ϊ����ʵ������Ҫ�IJ����ǣ���С�����Ҫ�������ܽ��ĸ�����ȫ��ת�ƺ��������A����ȷ�ⶨNa2CO3��Һ���V��mL�����õ��dz���������̼������Һ����������������ȫ���ɣ���A�����ϣ�B����ȷ����Ũ��c��mol/L Na2CO3��Һ�����õ��dz���������̼������Һ����������������ȫ���ɣ���̼����Ũ�Ⱦ�ȷ���أ���B�����ϣ�C������������ó���ϴ�ӣ�ϴ��ҺҲӦ������У���֤�ܽ�ĸ���������ȫ��������������C���ϣ��ʴ�Ϊ��C����5������һ�������Ĺ����м�����������ַ�Ӧ��ⶨ���ɶ�����̼�����ڱ�״���µ��������������̼Ԫ���غ����̼��ƵĴ��ȣ����巽��Ϊ����ȡCaCO3��ƷM g��������������ᣬ�ռ����ⶨ��״�������ɵ���������VmL���ʴ�Ϊ����ȡCaCO3��ƷM g��������������ᣬ�ռ����ⶨ��״�������ɵ���������VmL�� ��1��̼��������ᷴӦ��ʣ�������ʮ��֮һ������������Һ�кͣ�����̼��Ʒ�Ӧ������ΪC1V1��10��3��10C2V2��10��3 �� ��̼������ʵ���Ϊ0.5��C1V1��10��3��10C2V2��10��3�����ݴ˼���̼��ƴ��ȣ���2����CaO�������������Ӧ�����Է��ڸ���������ȴ����ֹ���ɵ�CaO������е�CO2��H2O��Ӧ���������3�������������ù�����������������̼��ƵĴ��ȣ��ݴ˷����жϣ���4����С�����Ҫ�������ܽ��ĸ�����ȫ��ת�ƺ����������5��ʵ����ƿ�������һ�������Ĺ����м�����������ַ�Ӧ��ⶨ���ɶ�����̼�����ڱ�״���µ��������������̼Ԫ���غ����̼��ƵĴ��ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������е㲻ͬ�ֻ��ܵ�Һ��������õķ�����
A. ���� B. ���� C. ��ȡ D. ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������ˮ�м�����ɫʯ����Һ��������________________��˵����ˮ�к��У��ѧʽ�����ӷ��ţ�____________������ˮ�м���NaHCO3��Һ������Ӧ�����ӷ���ʽΪ______________________��
��2����ȡƯ�۵Ļ�ѧ��Ӧ����ʽΪ______________________________________����Ӧ���������뻹ԭ����������Ϊ_________��Ư�۵���Ч�ɷ���________�����ڿ����б��ʵ�ԭ���ǣ��û�ѧ����ʽ��ʾ��_______________________��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��д��ȷ���ǣ� ��
A.NaOH=Na++O2-+H+
B.FeCl3=Fe3++Cl-
C.Ca(NO3)2=Ca2++2(NO3)2-
D.H2SO4=2H++SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й���������ȷ���ǣ� ��
A.��״���£�1L���������еķ�����Ϊ ![]()
B.1mol������CH3������������Ϊ9NA
C.��״���£�B2H6��C2H4�Ļ������22.4L�������ĵ�����Ϊ16NA
D.26g C2H2�ͱ������Ļ��������������Cԭ����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼̼������˫��������л���ɿ��������������ṹ�����������ֽṹ����
A.����ϩB.1��3��������ϩC.��Ȼ��D.����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����о�DZˮͧ�й�����ϵ��Ӧ������װ��ͼ(�г�������)��
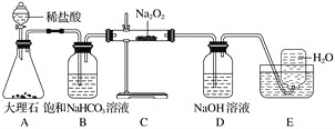
��1��Aװ��ΪCO2�ķ���װ�ã���Ӧ�����ӷ���ʽΪ____________________��
��2��Bװ�ÿɳ�ȥAװ���п��ܻӷ�����___________���ѧʽ������Ӧ�����ӷ���ʽΪ______________________________��
��3��Cװ��ΪO2�ķ���װ�ã���Ӧ�Ļ�ѧ����ʽΪ��________________________����________________________��
��4��Cװ���й����ɵ���ɫ��ȫ��Ϊ��ɫ���������ɷֵ�ʵ�鷽��Ϊȡ����Cװ���з�Ӧ��Ĺ�������ˮ������Һ�е������____________��Һ�����а�ɫ�������ɣ���֤�������к���____________�����ˣ�����Һ�е��뼸�η�̪��Һ����________�Ҳ���ɫ����֤�������к���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2��g��+3H2��g��2NH3��g����H��0�������о�Ŀ�ĺ�ʾ��ͼ������ǣ� ��
A | B | C | D | |
�о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P2��P1�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
ͼʾ |
|
|
|
|
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ķ�Ӧ·��������Ϣ��գ� 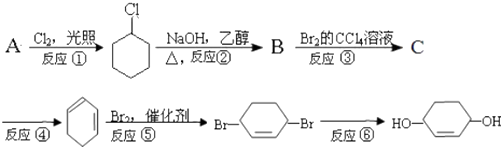
��1��A�Ľṹ��ʽΪ
��2���ڢ١��ĸ�����Ӧ�У�����ȡ����Ӧ���� �� ���ڼӳɷ�Ӧ���� ��
��3����Ӧ�����õ��Լ��������� ��
��4����Ӧ�۵Ļ�ѧ����ʽ�� ��
��5����Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com