
【题目】制备乙酸乙酯,乙酸正丁酯是中学化学实验中的两个重要有机实验
①乙酸乙酯的制备
②乙酸丁酯![]() 的制备
的制备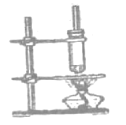
完成下列填空:
(1)制乙酸乙酯的化学方程式___________。
(2)制乙酸乙酯时,通常加入过量的乙醇,原因是________,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是________;浓硫酸用量又不能过多,原因是_______________。
(3)试管②中的溶液是________,其作用是________________。
(4)制备乙酸丁酯的过程中,直玻璃管的作用是________,试管不与石棉网直接接触的原因是_____。
(5)在乙酸丁酯制备中,下列方法可提高1-丁醇的利用率的是________(填序号)。
A.使用催化剂 B.加过量乙酸 C.不断移去产物 D.缩短反应时间
(6)两种酯的提纯过程中都需用到的关键仪器是________,在操作时要充分振荡、静置,待液体分层后先将水溶液放出,最后将所制得的酯从该仪器的________(填序号)
A.上口倒出 B.下部流出 C.都可以
【答案】![]() 增大反应物的浓度,使平衡正向移动,提高乙酸的转化率;; 浓硫酸能吸收反应生成的水,使平衡正向移动,提高酯的产率 浓硫酸具有强氧化性和脱水性,会使有机物碳化,降低酯的产率 饱和碳酸钠溶液 中和乙酸、吸收乙醇减少乙酸乙酯在水中的溶解 冷凝回流 防止加热温度过高,有机物碳化分解 BC 分液漏斗 A
增大反应物的浓度,使平衡正向移动,提高乙酸的转化率;; 浓硫酸能吸收反应生成的水,使平衡正向移动,提高酯的产率 浓硫酸具有强氧化性和脱水性,会使有机物碳化,降低酯的产率 饱和碳酸钠溶液 中和乙酸、吸收乙醇减少乙酸乙酯在水中的溶解 冷凝回流 防止加热温度过高,有机物碳化分解 BC 分液漏斗 A
【解析】
(1)实验室用乙醇和乙酸在浓硫酸加热的条件下制乙酸乙酯,化学方程式为![]() 。
。
答案为:![]() ;
;
(2)酯化反应属于可逆反应,加入过量的乙醇,相当于增加反应物浓度,可以让平衡生成酯的方向移动,提高酯的产率;在酯化反应中,浓硫酸的作用是催化剂和吸水剂;理论上"加入数滴浓硫酸即能起催化作用,但实际用量多于此量",原因是:利用浓硫酸能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;“浓硫酸用量又不能过多”,原因是:浓硫酸具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
答案为:增大反应物的浓度,使平衡正向移动,提高乙酸的转化率;浓硫酸能吸收反应生成的水,使平衡正向移动,提高酯的产率;浓硫酸具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
(3)由于乙酸和乙醇具有挥发性,所以制得的乙酸乙酯中常混有少量挥发出的乙酸和乙醇,将产物通到饱和碳酸钠溶液的液面上,饱和碳酸钠溶液的作用是:中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解;
答案为:饱和碳酸钠溶液;中和乙酸、吸收乙醇减少乙酸乙酯在水中的溶解;
(4)乙酸、丁醇加热易挥发,为减少原料的损失,直玻璃管对蒸汽进行冷凝,重新流回反应器内。试管与石棉网直接接触受热温度高,容易使有机物分解碳化。
故答案为:冷凝、回流;防止加热温度过高,有机物碳化分解。
(5)提高1丁醇的利用率,可使平衡向生成酯的方向移动。
A. 使用催化剂,缩短反应时间,平衡不移动,故A错误;
B. 加过量乙酸,平衡向生成酯的方向移动,1丁醇的利用率增大,故B正确;
C. 不断移去产物,平衡向生成酯的方向移动,1丁醇的利用率增大,故C正确;
D. 缩短反应时间,反应未达平衡,1丁醇的利用率降低,故D错误。
答案选BC。
(6)分离互不相溶的液体通常分液的方法,分液利用的仪器主要是分液漏斗,使用时注意下层液从分液漏斗管放出,上层液从分液漏斗上口倒出,酯的密度比水小,应从分液漏斗上口倒出。
故答案为:分液漏斗;A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向10 mL某浓度的AlCl3溶液中滴加1.5 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
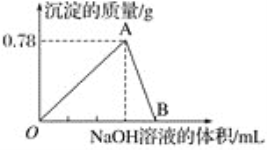
(1)图中B点溶液中的溶质有________________。
(2)O点到B点反应的总离子方程式可表示为________________。
(3)反应至A点时消耗NaOH溶液的体积为______________。
(4)AlCl3溶液的浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
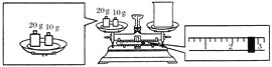
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
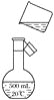
①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称半导体材料,它的发现和使用曾引起计算机的一场革命,这种材料可以按下列方法制备,下列说法正确的是
![]()
A.二氧化硅的分子式是SiO2
B.步骤①的化学方程式是SiO2 + C ![]() Si + CO2↑
Si + CO2↑
C.步骤③中,每生成1mol Si,转移4mol电子
D.二氧化硅能与氢氟酸发生反应,而硅单质不能与氢氟酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
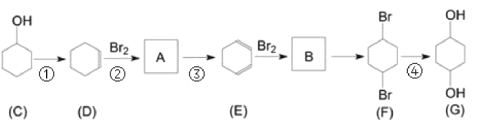
【题目】有机物G(1,4-环己二醇)是重要的医药中间体和新材料单体,可通过以下流程制备。
完成下列填空:
(1)写出C中含氧官能团名称_____________。
(2)判断反应类型:反应①________;反应②_______。
(3)写出B的结构简式_______________。
(4)写出反应③的化学方程式_________。
(5)一定条件下D脱氢反应得一种产物,化学性质稳定,易取代、难加成。该产物属于____(填有机物类别),说明该物质中碳碳键的特点________________________。
(6)写出G与对苯二甲酸在一定条件下反应生成高分子物质的化学方程式_____________。
(7)1,3-丁二烯是应用广泛的有机化工原料,它是合成D的原料之一,它还可以用来合成氯丁橡胶(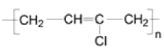 ).写出以1,3-丁二烯为原料制备氯丁橡胶的合成路线。(合成路线常用的表示方式为:A
).写出以1,3-丁二烯为原料制备氯丁橡胶的合成路线。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_______________
目标产物)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ① | |||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ② | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素⑩的氢化物的电子式为___,此氢化物的还原性比元素⑨的氢化物__(强或弱),请用一个化学方程式证明这一事实___。
(2)分别写出⑧⑨⑩最高价氧化物对应的水化物的化学式___,并比较其酸性的强弱__
(3)能生成两性氢氧化物的元素是___,其最高价氧化物的水化物电离方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究金属腐蚀的条件和速率,某课外兴趣活动小组学生用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是
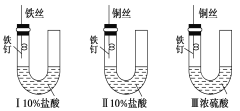
A.实验结束时,装置Ⅰ左侧的液面会下降
B.实验结束时,左侧液面装置Ⅰ比装置Ⅱ的低
C.实验结束时,装置Ⅱ中的铁钉腐蚀最严重
D.实验结束时,装置Ⅲ中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活动小组同学用下图1装置进行实验,试回答下列问题。
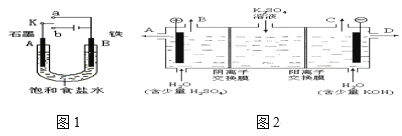
(1)若开始时开关K与a连接,则A极的电极反应式为____。
(2)若开始时开关K与b连接,则A极的电极反应式为____。
(3)当开关K与b连接时,关于这个实验,下列说法正确的是(填序号)____。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①制得的氢氧化钾溶液从出口(填“A”、“B”、“C”、“D”)___导出,制得的氧气从出口(填“A”、“B”、“C”、“D”)___导出。
②此时通过阴离子交换膜的离子数___(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
③通电开始后,阴极附近溶液pH会增大,请简述原因___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com