
【题目】某溶液含有①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是(设溶液体积无变化) ( ).
A.①B.①④⑤C.①③⑤D.①③④⑤
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金属钠着火使用泡沫灭火器灭火 B. 用湿润的KI淀粉试纸鉴别Br2(g)和NO2
C. 工业上利用合成氨实现人工固氮 D. 酸性氧化物均能与水反应生成对应的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
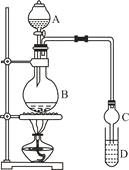
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯(b)、立方烷(d)、环辛四烯(p)的分子式均为C8H8。下列说法正确的是

A. b、d的二氯代物均只有三种 B. b、p均能与酸性高锰酸钾溶液反应
C. d是烷烃,只能取代,不能加成 D. b和苯乙炔一样,所有原子一定处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。下列推断正确的是

A. 用pH试纸测定E点对应的溶液,其pH=3
B. F、H点对应的溶液中都存在c(Na+)=c(Cl-)+c(ClO-)
C. G点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
D. 加水稀释H点对应的溶液,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中利用CoCl2·6H2O为原料制取三氯化六氨合钴[Co(NH3)6Cl3]的实验步骤如下:
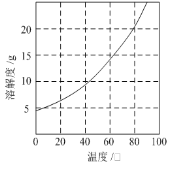
已知:①Co(NH3)6Cl3在不同温度下水中的溶解度曲线如图。
②在Co(NH3)6Cl3溶液中加入一定量盐酸有利于结晶。
③Ksp[Co(OH)2]=1.09×10-15,Ksp[Co(OH)3]=2×10-44。
(1)在实验过程中NH4Cl除作反应物外,还可防止在滴加氨水时c(OH-)过大,其原理是______。
(2)氧化过程中加入氨水和H2O2在溶液中生成Co(NH3)6Cl3。
①氧化时须先加入氨水再加入H2O2,其原因是______。
②该反应的化学方程式为______。
③反应时需要控制反应温度在50 ℃~60 ℃之间,可采取的加热方式是______。
(3)冰水冷却的目的是______。
(4)请补充完整由过滤后所得滤渣获取Co(NH3)6Cl3的实验方案:将滤渣加入沸水中,充分搅拌,______,低温干燥。(实验中须使用的试剂:盐酸、乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:______________ 、________________;
(2)第③步中,生成氢氧化铝的离子方程式是_____________。若往A溶液中通入足量CO2,产生的沉淀为____________________(填化学式);
(3)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中不正确的是( )
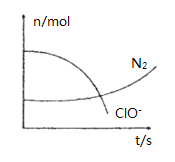
A. 还原剂是含CN-的物质,氧化产物只有N2
B. 氧化剂是ClO-,HCO3-是氧化产物
C. 参与反应的氧化剂与还原剂的物质的量之比为5:2
D. 标准状况下若生成2.24LN2,则转移电子1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和02。下列说法中正确的是

A. 该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
B. 该电池放电时,Li+向电极X方向移动
C. 该电池充电时,电极Y与外接直流电源的负极相连
D. 该电池放电时,每转移4mol电子,理论上生成1molC
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com